ALLEGATO 1
Disposizioni in materia di trasparenza dei rapporti tra le imprese produttrici, i soggetti che operano nel settore della salute e le organizzazioni sanitarie. C. 491 Massimo Enrico Baroni.
PROPOSTE EMENDATIVE APPROVATE
ART. 3.
Al comma 1, apportare le seguenti modificazioni:
a) alla lettera a), sostituire le parole: 10 euro con le seguenti: 50 euro e le parole: 100 euro con le seguenti: 500 euro;
b) alla lettera b), sostituire le parole: 1.000 euro con le seguenti: 2.500 euro.
3. 1. (Nuova formulazione). Panizzut, Boldi, De Martini, Foscolo, Lazzarini, Locatelli, Tiramani, Ziello.
Al comma 2, sostituire le parole: relazioni d'interesse, dirette o indirette, con le seguenti: accordi tra le imprese produttrici e i soggetti che operano nel settore della salute o le organizzazioni sanitarie, che producono vantaggi diretti o indiretti.
Conseguentemente, al medesimo articolo 3, apportare le seguenti modificazioni:
a) al comma 3, alinea, e al comma 4, alinea, e lettere a), c), d), e), f) e g), sostituire le parole: relazione d'interesse con le seguenti: accordo;
b) al comma 3, alinea, e al comma 5, sostituire le parole: relazioni d'interesse con le seguenti: accordi;
c) sostituire la rubrica dell'articolo con la seguente: Pubblicità delle erogazioni e degli accordi.
3. 23. (Nuova formulazione). Massimo Enrico Baroni, Lorefice, Mammì, Menga, Nappi, Nesci, Sapia, Sarli, Sportiello, Trizzino, Troiano, Leda Volpi, Bologna, D'Arrando, Lapia.
Al comma 2, sopprimere le parole:, anche a titolo gratuito od onorifico,.
*3. 2. (Nuova formulazione). Panizzut, Boldi, De Martini, Foscolo, Lazzarini, Locatelli, Tiramani, Ziello.
Al comma 2, sopprimere le parole:, anche a titolo gratuito od onorifico,.
*3. 15. (Nuova formulazione). Ubaldo Pagano, De Filippo, Siani, Carnevali, Pini, Campana, Schirò, Rizzo Nervo.
Al comma 2, sopprimere le parole:, anche a titolo gratuito od onorifico,.
*3. 5. (Nuova formulazione). Rostan.
Al comma 4, lettera e), sostituire le parole da: normale fino alla fine del periodo, con le seguenti: di mercato.
3. 24. Mammì, Menga, Nappi, Nesci, Sapia, Sarli, Sportiello, Trizzino, Troiano, Leda Volpi, Massimo Enrico Baroni, Bologna, D'Arrando, Lapia, Lorefice.
Al comma 5, sostituire, ovunque ricorra, la parola: trimestre con la seguente: semestre.
*3. 18. (Nuova formulazione). Ubaldo Pagano, De Filippo, Siani, Carnevali, Pini, Campana, Schirò, Rizzo Nervo.
Al comma 5, sostituire, ovunque ricorra, la parola: trimestre con la seguente: semestre.
*3. 4. Panizzut, Boldi, De Martini, Foscolo, Lazzarini, Locatelli, Tiramani, Ziello.
Al comma 5, sostituire, ovunque ricorra, la parola: trimestre con la seguente: semestre.
*3. 12. Pedrazzini, Mugnai, Bond, Bagnasco, Brambilla, Minardo, Novelli, Versace.
Al comma 5, sostituire, ovunque ricorra, la parola: trimestre con la seguente: semestre.
*3. 8. (Nuova formulazione). Rostan.
ALLEGATO 2
Disposizioni per l'adempimento degli obblighi derivanti dall'appartenenza dell'Italia all'Unione europea – Legge europea 2018. C. 1432 Governo, approvato dal Senato.
RELAZIONE APPROVATA DALLA COMMISSIONE
La XII Commissione (Affari sociali),
esaminato, per le parti di propria competenza, il disegno di legge europea 2018 (C. 1432 Governo, approvato dal Senato);
evidenziate, in particolare, le modifiche introdotte dall'articolo 14, concernente le buone prassi di fabbricazione dei medicinali per uso umano, finalizzate al recepimento della direttiva (UE) 2017/1572 della Commissione, e dall'articolo 15 del disegno di legge, con il quale si designa il Ministero della salute come autorità competente in materia di dispositivi medici, consentendo così di adeguare il nostro ordinamento interno ai regolamenti UE 745 e 746 del 2017, adottati nella stessa materia;
considerato che l'articolo da ultimo citato risulta di particolare urgenza e necessità, in quanto il termine posto dai predetti regolamenti è scaduto il 26 novembre 2017 e la predetta designazione consente di garantire l'esercizio delle funzioni richieste dalla normativa europea, da parte del Ministero della salute, per evitare gravi conseguenze in materia di controllo del mercato, della sicurezza ed efficacia dei prodotti e, più in generale, per garantire la tutela della salute pubblica;
segnalato, inoltre, l'articolo 1 che, prevedendo alcune modifiche alla disciplina in materia di riconoscimento delle qualifiche professionali, volte in parte a definire questioni oggetto della procedura europea di infrazione 2018/2175, riguarda anche alcune professioni sanitarie;
osservato, altresì, che l'articolo 13, in materia di diritto d'autore, investe le competenze della Commissione Affari sociali per le finalità per le quali sono previste eccezioni al diritto d'autore e ai diritti connessi – in attuazione della direttiva (UE) 2017/1564 – consistenti nel garantire che le persone non vedenti, con disabilità visive o con altre difficoltà nella lettura di testi a stampa abbiano accesso ai libri e ad altri tipi di pubblicazioni su qualsiasi supporto, anche in formato audio, e in formato digitale,
DELIBERA DI RIFERIRE FAVOREVOLMENTE.
ALLEGATO 3
5-00551 Bologna: Rivalutazione del prezzo del farmaco Raxone per il trattamento della compromissione visiva.
TESTO DELLA RISPOSTA
In merito a quanto delineato nell'interrogazione parlamentare in esame, l'Agenzia Italiana del Farmaco (AIFA) ha inteso sottolineare che il medicinale «Raxone» a base del principio attivo «idebenone» è un farmaco designato come «orfano» e viene ad oggi rimborsato per il trattamento della compromissione visiva in pazienti adulti e adolescenti affetti da neuropatia ottica ereditaria di Leber.
I farmaci «orfani» sono medicinali autorizzati per il trattamento di alcune malattie, per lo più rare, per i quali le aziende farmaceutiche appaiono restie ad effettuare investimenti in ricerca e in sviluppo, a causa della domanda insufficiente a coprire i relativi costi di sviluppo, produzione e fornitura.
Si definiscono farmaci «orfani» perché manca l'interesse, da parte delle industrie farmaceutiche, ad investire su medicinali destinati ad un numero limitato di pazienti, anche se tali farmaci rispondono ad un bisogno di salute pubblica.
Lo status di «orfano» viene dato ad un determinato farmaco anche al fine di incoraggiarne lo sviluppo, in quanto necessario per curare una determinata patologia, nonostante esso sia, dal punto di vista dei costi, insufficientemente redditizio per le aziende farmaceutiche, se commercializzato secondo la normativa ordinaria.
Il Regolamento europeo n. 141/2000, concernente i medicinali «orfani», dispone che tali prodotti sono obbligatoriamente soggetti alla procedura centralizzata europea di autorizzazione all'immissione in commercio.
La richiesta di designazione di prodotto medicinale «orfano» è gratuita e può essere effettuata in qualsiasi momento durante il periodo di sviluppo del prodotto stesso.
Tuttavia, la richiesta di designazione di prodotto medicinale «orfano» deve essere effettuata prima di presentare all'European Medicines Agency la domanda di autorizzazione all'immissione in commercio.
Secondo il Regolamento europeo n. 141/2000, per poter essere designato medicinale «orfano», il prodotto deve soddisfare determinati criteri:
deve essere destinato al trattamento, alla prevenzione o alla diagnosi di una patologia che comporta una minaccia per la vita o la debilitazione cronica;
l'incidenza di tale patologia nell'Unione europea non deve superare i 5 individui su 10.000, oppure deve risultare improbabile che la commercializzazione di tale farmaco sia tanto redditizia da giustificare l'investimento necessario per il relativo sviluppo;
non esistono metodi soddisfacenti di diagnosi, prevenzione o trattamento della patologia in questione, oppure, se tali metodi esistono, il farmaco avrà effetti benefici significativi per i soggetti colpiti da tale patologia.
A complemento della richiesta di designazione di prodotto medicinale «orfano», sono necessari alcuni dati clinici e/o non clinici preliminari (studio di fattibilità).
Nel caso di un farmaco già autorizzato, è possibile effettuare una richiesta di designazione di prodotto medicinale «orfano» per una nuova indicazione «orfana» non ancora autorizzata.
L'ottenimento della designazione di farmaco «orfano» conferisce al medicinale un'esclusiva di mercato per 10 anni e, in Italia, l'accesso ad una procedura di negoziazione del prezzo con termini abbreviati, ai sensi dell'articolo 12, comma 3, del decreto-legge n. 158/2012, convertito con modificazioni nella legge n. 189/2012: inoltre, tale designazione consente al titolare dell'autorizzazione all'immissione in commercio di non essere tenuto al ripiano dell'eventuale superamento del tetto della spesa farmaceutica.
In merito alla questione delineata nell'atto ispettivo in esame, l'AIFA sottolinea che il farmaco «Mnesis» a base dello stesso principio attivo «idebenone» non è un farmaco «orfano», è classificato in fascia di non rimborsabilità (classe C), ed è registrato per l'indicazione: «trattamento dei deficit cognitivo-comportamentali conseguenti a patologie cerebrali sia di origine vascolare che degenerativa»; quindi ha un'indicazione del tutto distinta rispetto al medicinale «orfano» «Raxone».
L'AIFA segnala, inoltre, che la presentazione delle domande di registrazione come «orfano» di un medicinale a base di un principio attivo già in commercio come farmaco ad uso consolidato non costituisce un caso isolato.
Infatti, esistono casi in cui, per un principio attivo «datato» viene registrata, a livello europeo, una nuova indicazione orfana, che prevede, nella fase di rimborsabilità in Italia, la richiesta di un prezzo enormemente più alto rispetto a quello delle specialità medicinali già in commercio con lo stesso principio attivo ma con differenti indicazioni terapeutiche (non orfane).
Considerata anche l'esclusiva di mercato per 10 anni di cui godono i farmaci designati «orfani» (decorrente dalla data di designazione come tale), per il trattamento delle patologie relative all'indicazione «orfana» è obbligatorio l'uso della specialità «orfana», in applicazione di quanto stabilito all'articolo 8 del Regolamento europeo n. 141/2000.
In tal senso si è espresso il Tribunale dell'Unione europea nella decisione relativa alla causa T-452/14: il Tribunale ha sostanzialmente ribadito che, in presenza di una esclusiva attribuita ad un farmaco «orfano» nel trattamento di una o più indicazioni terapeutiche e fino alla scadenza decennale di detta esclusiva, non possono essere autorizzati medicinali «orfani» per quella stessa indicazione, né possono essere consentiti usi «off-label» che vadano ad inficiare il diritto di esclusiva decennale attribuito dal Regolamento europeo, tanto più in forza della considerazione per cui l'uso «off-label» dei medicinali non forma oggetto della normativa U.E.
Oltre al caso citato, sussistono casistiche legate ai principi attivi, come ad esempio: acido colico, chetoconazolo, idroxicarbamide, acido chenodesossicolico ed altri.
Quanto al confronto di costo tra i due farmaci citati nell'atto ispettivo, l'AIFA ha inteso precisare che, pur considerando l'approccio costo/mg. (anziché il più corretto criterio basato sul raffronto costo terapia/costo die sulla base della posologia prevista per lo specifico farmaco), il prezzo riportato per Raxone è il prezzo al pubblico.
Nel caso di specie, detto farmaco è acquistato in distribuzione diretta, in applicazione di un contratto sottoscritto con AIFA che prevede l'applicazione di uno sconto del 57,50 per cento.
Pertanto, nel confronto di costo andrebbe confrontato il prezzo «ex factory» (calcolato escludendo i margini della distribuzione — farmacista, grossista) al netto delle riduzioni di legge previste e dello sconto del Servizio Sanitario Nazionale (2.684,94 euro) con un costo per mg. pari ad euro 0,099 per il medicinale «Raxone», rispetto al costo per mg. del farmaco «Mnesis» «ex factory», calcolato come il 50 per cento rispetto al prezzo al pubblico considerato (costo mg. euro 0,019).
Da ultimo, si osserva che alla scadenza del termine temporale della esclusiva di cui sopra, sarà attivata da parte di AIFA la procedura per un uso più appropriato ed efficiente del principio attivo in questione.
ALLEGATO 4
5-00652 Ascani: Riorganizzazione del servizio sanitario e del sistema universitario.
TESTO DELLA RISPOSTA
Il Ministero della salute segue con particolare attenzione i vari aspetti della problematica descritta nell'interrogazione parlamentare in esame.
Nei prossimi anni, in effetti, si verificherà una importante fuoriuscita dal mercato del lavoro sia di medici specialisti, con pensionamenti numericamente più consistenti per alcune specializzazioni, sia di medici di medicina generale.
Prendendo in considerazione i medici iscritti ad una qualsiasi delle casse previdenziali ENPAM, e quindi indipendentemente dal settore di impiego e dal loro «status» occupazionale, risulta che oltre il 15 per cento ha un'età uguale o superiore ai 65 anni; in particolare esiste una forte concentrazione di medici compresi nelle fasce di età 55-59 e 60-64, in cui si collocano complessivamente circa 120.000 medici.
Tuttavia, è opportuno considerare che tale fenomeno è la fisiologica conseguenza della cosiddetta «pletora medica» degli anni ‘70-‘80, ossia del periodo in cui gli accessi al Corso di Laurea in Medicina e Chirurgia non erano regolati dal numero chiuso e le Facoltà di Medicina accoglievano un numero considerevole di immatricolati, diventati i medici che nei prossimi anni andranno in pensione.
In riferimento al solo Servizio Sanitario Nazionale, si evince che oltre il 47 per cento dei medici da esso dipendenti ha un'età compresa tra i 55 ed i 64 anni, ossia appartiene alle classi di età che corrispondono alle future uscite dal mercato del lavoro ed al picco della gobba pensionistica.
La medesima percentuale, calcolata sul totale dei medici iscritti all'ENPAM di età inferiore ai 75 anni, è pari a circa il 34 per cento.
Più in particolare, si evince che nel periodo di tempo 2010-2016 il numero di Dirigenti medici con rapporto di lavoro a tempo indeterminato è passato da 111.362 unità a 105.086 unità, con un decremento complessivo di 6.276 unità, ossia di circa 6 punti percentuali.
Tuttavia, nel medesimo arco temporale si è registrato un importante aumento del numero dei medici assunti presso le strutture del Servizio Sanitario Nazionale con contratto di lavoro a tempo determinato.
In termini di «unità uomo equivalenti», infatti, tale contingente di personale medico è passato dalle 7.206 unità dell'anno 2010 alle 8.943 unità nell'anno 2016 (+24 per cento).
Del resto, occorre tener conto dei vincoli alle assunzioni disposti dalla normativa per motivi di contenimento dei costi.
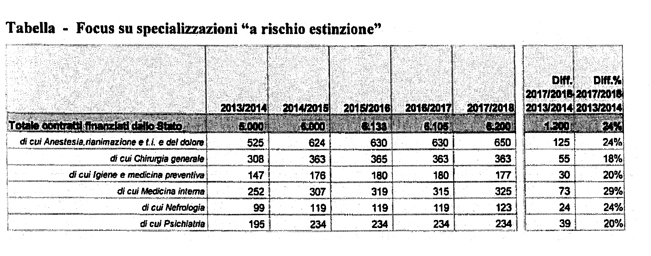
In ogni caso, nella prospettiva dell'imminente approssimarsi della «gobba pensionistica» e nell'ottica di garantire il necessario prosieguo del percorso formativo dei neolaureati in medicina, propedeutico all'effettivo esercizio della profes- sione, il Governo si è impegnato a trovare risorse aggiuntive per il finanziamento dei contratti di formazione medico-specialistica, i quali sono passati da un totale di 5.000 contratti finanziati dallo Stato per l'Anno Accademico 2013/2014, a 6.200 contratti complessivi per l'Anno Accademico 2017/2018, con un incremento percentuale pari al 24 per cento.
Inoltre, è opportuno ricordare che è cresciuto anche il numero di contratti finanziati dalle Regioni e da altri Enti pubblici o privati.
Per consentire di evidenziare con maggiore dettaglio la situazione relativa alle specializzazioni mediche, metto a disposizione dell'On.le interrogante e della Commissione una tabella che mette in luce le variazioni, in aumento, del numero di contratti di formazione assegnati alle Scuole di specializzazione nel corso dell'ultimo quinquennio accademico.
In particolare, per la specializzazione di Anestesia, Rianimazione e Terapia Intensiva e del Dolore, particolarmente richiamata nell'interrogazione in esame, nell'Anno Accademico 2017/2018 sono stati finanziati con risorse statali 650 contratti, per un quantitativo di 125 contratti aggiuntivi rispetto all'Anno Accademico 2013/2014, con un incremento percentuale del 24 per cento.
La tabella dimostra come sia in corso un processo di ridefinizione del numero di posti disponibili per l'accesso alla formazione post-laurea dei neo laureati in Medicina, a riprova dell'impegno da parte del Governo e delle Amministrazioni regionali nel reperire le risorse finanziarie incrementali necessarie al conseguimento di tale scopo.
In effetti, il punto cruciale non è tanto la numerosità di contratti di formazione specialistica, quanto la distribuzione degli stessi tra le diverse tipologie di Scuole.
È in questo contesto che potrà inserirsi il proseguimento dei lavori relativi alla metodologia di pianificazione e previsione del personale sanitario, che è stata sviluppata ed estesa a tutte le figure professionali.
Una «naturale» evoluzione dell'attività posta in essere sul tema della programmazione potrebbe essere la sua applicazione all'universo delle specializzazioni mediche, proprio allo scopo di pervenire ad una distribuzione ottimale dei contratti di formazione, tenuto conto dei principi cardine della programmazione: orizzonte temporale di medio-lungo periodo, fabbisogno inteso per il sistema sanitario nel suo complesso, offerta e domanda di professionisti messe in relazione al fine di identificare la capacità di assorbimento del mercato del lavoro, quantificare le eventuali carenze o eccedenze di personale nel futuro e porre in essere le azioni opportune per prevenirle.
Inoltre, l'attenzione potrà essere focalizzata anche su alcuni segnali che provengono dal mondo del lavoro, e che mettono in luce nuove tendenze in atto.
Pervengono, infatti, al Ministero della salute diverse segnalazioni che suggeriscono che alcune scelte lavorative dei giovani medici vengono condizionate da ragioni legate a prospettive di guadagni più sostanziosi ed alla maggiore flessibilità nell'organizzazione dell'orario di lavoro, che la libera professione o l'impiego nel settore privato sono in grado di offrire.
Per quanto riguarda le risorse finanziarie, si fa presente che la legge 30 dicembre 2018, n. 145, «Bilancio di previsione dello Stato per l'anno finanziario 2019 e bilancio pluriennale per il triennio 2019-2021», prevede ulteriori 10 milioni di euro annui, a decorrere dall'anno 2019, da destinare ad un numero aggiuntivo di borse di studio per i corsi di formazione specifica in Medicina Generale, nonché ulteriori risorse per i contratti di formazione specialistica pari a 22,5 milioni di euro per l'anno 2019, 45 milioni di euro per l'anno 2020, 68,4 milioni di euro per l'anno 2021, 91,8 milioni di euro per l'anno 2022 e 100 milioni di euro annui a decorrere dal 2023.
Concludo facendo presente che proprio in questi giorni si discuteranno al Senato, nell'ambito dell’iter di conversione del decreto-legge «Semplificazioni», ulteriori misure volute dal Governo che vanno nella direzione di favorire l'accesso all'impiego nel Servizio sanitario nazionale, anche ai medici di medicina generale, garantendo loro la dovuta formazione e, al tempo stesso, l'erogazione dei servizi e dei Livelli essenziali di assistenza in modo omogeneo su tutto il territorio nazionale.