Sulla pubblicità dei lavori:
Catania Mario , Presidente ... 3
AUDIZIONI IN MATERIA DI CONTRASTO DELLA CONTRAFFAZIONE NEL SETTORE FARMACEUTICO
Audizione del presidente di Farmindustria, Massimo Scaccabarozzi.
Catania Mario , Presidente ... 3 ,
Scaccabarozzi Massimo , presidente di Farmindustria ... 3 ,
Catania Mario , Presidente ... 5 ,
Scaccabarozzi Massimo , presidente di Farmindustria ... 5 ,
Catania Mario , Presidente ... 5 ,
Russo Paolo (FI-PdL) ... 5 ,
Scaccabarozzi Massimo , presidente di Farmindustria ... 5 ,
Russo Paolo (FI-PdL) ... 5 ,
Scaccabarozzi Massimo , presidente di Farmindustria ... 5 ,
Russo Paolo (FI-PdL) ... 5 ,
Scaccabarozzi Massimo , presidente di Farmindustria ... 6 ,
Russo Paolo (FI-PdL) ... 6 ,
Scaccabarozzi Massimo , presidente di Farmindustria ... 6 ,
Catania Mario , Presidente ... 6 ,
Scaccabarozzi Massimo , presidente di Farmindustria ... 7 ,
Catania Mario , Presidente ... 7 ,
Bordo Franco (SI-SEL) ... 7 ,
Scaccabarozzi Massimo , presidente di Farmindustria ... 7 ,
Bordo Franco (SI-SEL) ... 7 ,
Scaccabarozzi Massimo , presidente di Farmindustria ... 7 ,
Chimenti Maria Grazia , responsabile Area Gruppi specifici, Spesa farmaceutica, Rapporti con le associazioni di filiera ... 7 ,
Catania Mario , Presidente ... 7 ,
Russo Paolo (FI-PdL) ... 8 ,
Catania Mario , Presidente ... 8
Audizione del Direttore del Centro di Ricerca in Farmacoeconomia e Farmacoutilizzazione CIRFF Ettore Novellino:
Catania Mario , Presidente ... 8 ,
Novellino Ettore , direttore del Centro di Ricerca in Farmacoeconomia e Farmacoutilizzazione CIRFF ... 8 ,
Catania Mario , Presidente ... 10 ,
Russo Paolo (FI-PdL) ... 10 ,
Novellino Ettore , direttore del Centro di Ricerca in Farmacoeconomia e Farmacoutilizzazione CIRFF ... 10 ,
Catania Mario , Presidente ... 10 ,
Novellino Ettore , direttore del Centro di Ricerca in Farmacoeconomia e Farmacoutilizzazione CIRFF ... 10 ,
Catania Mario , Presidente ... 10 ,
Russo Paolo (FI-PdL) ... 10 ,
Catania Mario , Presidente ... 10
Audizione di rappresentanti dell'Associazione Distributori Farmaceutici ADF:
Catania Mario , Presidente ... 11 ,
Farris Walter , Direttore generale dell'Associazione distributori Farmaceutici ADF ... 11 ,
Catania Mario , Presidente ... 11 ,
Porcelli Roberto ... 11 ,
Catania Mario , Presidente ... 12 ,
Russo Paolo (FI-PdL) ... 12 ,
Porcelli Roberto ... 13 ,
Russo Paolo (FI-PdL) ... 13 ,
Porcelli Roberto ... 13 ,
Russo Paolo (FI-PdL) ... 13 ,
Porcelli Roberto ... 13 ,
Russo Paolo (FI-PdL) ... 13 ,
Porcelli Roberto ... 14 ,
Catania Mario , Presidente ... 14
ALLEGATO: Documentazione prodotta dagli auditi ... 15
PRESIDENZA DEL PRESIDENTE
MARIO CATANIA
La seduta comincia alle 14.20.
(La Commissione approva il processo verbale della seduta precedente).
Sulla pubblicità dei lavori.
PRESIDENTE. Avverto che, se non vi sono obiezioni, la pubblicità dei lavori della seduta odierna sarà assicurata anche attraverso impianti audiovisivi a circuito chiuso.
(Così rimane stabilito).
Audizione del presidente di Farmindustria, Massimo Scaccabarozzi.
PRESIDENTE. L'ordine del giorno reca, nell'ambito dell'approfondimento tematico in materia di contrasto della contraffazione nel settore farmaceutico, l'audizione del presidente di Farmindustria, Massimo Scaccabarozzi, che è accompagnato dalla dottoressa Nadia Ruozzi, capo Area relazioni istituzionali di Farmindustria, dottoressa Maria Grazia Chimenti, responsabile Area Gruppi specifici, Spesa farmaceutica, Rapporti con le associazioni di filiera e distribuzione di Farmindustria, dottor Antonio Morelli, Capo ufficio stampa di Farmindustria.
Cedo quindi la parola al presidente di Farmindustria, Massimo Scaccabarozzi.
MASSIMO SCACCABAROZZI, presidente di Farmindustria. Grazie, presidente. Grazie dell'invito a questa audizione che ci consente di portare la posizione e la situazione che oggi c'è nel nostro Paese relativamente alla problematica in discussione.
In Italia, grazie alla severità e alla molteplicità dei controlli esistenti e a un sistema di rimborso che prevede la messa a disposizione dei farmaci per tutti i pazienti che ne abbiano bisogno, la contraffazione farmaceutica è un fenomeno pressoché assente, rappresenta una percentuale bassissima, inferiore al 5 per cento.
Questo è dovuto al fatto che ogni passaggio è estremamente controllato fin dalle officine di produzione, perché per produrre i farmaci noi siamo sottoposti a ispezioni continue, anche per spostare una macchina per la produzione da un reparto all'altro dobbiamo avere l'autorizzazione dell'organismo di vigilanza che sta nell'AIFA, l'Agenzia italiana del farmaco, però questi controlli proseguono anche a livello di tutte le aziende del farmaco, dei depositi, dei grossisti, di tutta la filiera, fino alle farmacie e all'ospedale.
Anche quando il farmaco scade è previsto un sistema di raccolta e distruzione dei farmaci scaduti attraverso una società che si chiama Assinde, che ha un sistema di controllo estremamente consolidato, quindi passa nelle farmacie a ritirare i farmaci scaduti e li porta a distruzione.
Nel nostro Paese abbiamo anche una specificità che è in atto dal 1988 ed è un altro strumento molto importante: il bollino ottico del Poligrafico dello Stato. Questo bollino ottico ha un codice a barre univoco per tutte le confezioni dei farmaci e, grazie a questo bollino, noi siamo nella condizione di poter seguire tutto l’iter del farmaco, dal confezionamento fino all'utilizzo, quindi ogni confezione grazie al bollino ottico ha un percorso strettamente monitorato. Pag. 4
Se tutto questo in Italia fa sì che il problema della contraffazione praticamente non esista, se non in quello che vi dirò dopo, nel mondo la situazione è diversa, perché questo fenomeno a livello mondiale è in espansione. Pensate che nel 2014 ci sono stati 2.177 fenomeni, mentre nel 2015 siamo passati a oltre 3.000, e questo significa che questa pratica sta prendendo piede fuori dell'Italia.
Ovviamente i farmaci coinvolti sono di varie tipologie. Il problema della contraffazione nei Paesi sviluppati come il nostro riguarda due grosse categorie di farmaci, i farmaci per il potenziamento fisico e per il potenziamento sessuale, e in nessuno di questi casi si può dire che il farmaco sia equivalente all'originale, soprattutto per quanto riguarda la qualità del farmaco in sé, la sicurezza del farmaco e l'efficacia del farmaco. Perché? Perché questi contraffattori non producono con le norme stringenti che noi abbiamo e non sono sottoposti ai controlli, perché generalmente dietro queste produzioni c'è un malaffare.
I controlli non ci sono nemmeno per quanto riguarda la conservazione e la distribuzione di questi farmaci. In qualche caso (lo dicono i rapporti dei NAS) il principio attivo è assente o sottodosato, in molti altri casi il farmaco può contenere addirittura sostanze tossiche che non fanno il bene del paziente e soprattutto vanno a minare la fiducia che potrebbe avere nel medico che gli ha prescritto il farmaco o nelle aziende produttrici di questo farmaco.
Il problema è diventato di rilevanza anche in Europa, e non a caso c'è una direttiva, la 2011/62/UE, che ha in qualche modo regolamentato la tracciatura. Questa direttiva prevede che ci sia uno strumento stampato su tutte le confezioni dei farmaci, anche questo univoco, un codice datamatrix che contiene tutte le informazioni relativamente a quella scatoletta.
Ovviamente questo dovrà essere operativo in tutti i Paesi europei a partire dal 2019, ai tre Paesi (Italia, Grecia e Belgio) che hanno già un sistema di tracciatura sono stati concessi sei anni in più, quindi si va fino al 2025. Noi cercheremo di farlo prima, cercheremo di essere allineati agli altri Paesi europei, per non perdere l'opportunità e, anche se abbiamo già un sistema nazionale che funziona molto bene dal 1988, per essere allineati alla data del febbraio 2019, anche perché esportiamo molto verso le filiali europee.
La produzione che noi abbiamo oggi si avvale infatti di un export pari al 72 per cento di quello che produciamo, quindi dobbiamo essere allineati, altrimenti non potremo produrre farmaci da mettere a disposizione degli altri Paesi e soprattutto perché attraverso questo bollino si va a normare tutta la parte relativa all’export parallelo. Oggi, infatti, in virtù del fatto che i farmaci in Italia costano meno che in altri Paesi si assiste nella filiera della distribuzione a un acquisto dei farmaci direttamente in Italia (non possiamo rifiutarci di distribuire i farmaci quando ci vengono richiesti), farmaci che poi vengono esportati all'estero, dove la filiera distributiva ha introiti maggiori perché lì i prezzi sono più alti.
Questo comporta un fenomeno di carenza di farmaci, che si è verificato qualche volta nel nostro Paese, perché magari una certa tipologia di farmaco viene esportato all'estero nell'esportazione parallela e non viene lasciata per i pazienti italiani. Con il fatto che ci sarà questo datamatrix la legge prevede che quando un farmaco viene esportato in questo modo debba essere riconfezionato, perché deve contenere tutti i dati relativamente al Paese europeo in cui viene esportato.
Questo è fondamentale non solo per il monitoraggio al di fuori del nostro Paese dei farmaci che sono destinati al nostro Paese, ma anche affinché non si verifichino più nel nostro Paese fenomeni di carenza di farmaci per cui i pazienti non li trovano e devono reperirli all'estero. Tra l'altro, siccome questo prevede che gli operatori che esportano siano autorizzati a livello regionale, darà anche la possibilità alle regioni di controllare che gli operatori agiscano correttamente e non scorrettamente nel portare il farmaco fuori.
Come Farmindustria abbiamo collaborato molto bene negli anni scorsi, creando Pag. 5l'Unità prevenzione della contraffazione presso l'AIFA, e insieme abbiamo realizzato uno spazio web che si chiama Medicrime, che contiene tutte le informazioni, i loghi dei nostri prodotti, i loghi delle aziende, in modo tale che si possa verificare immediatamente se il farmaco sia vero o contraffatto, e dove le aziende accedono per inserire tutti i dati relativi a furti o smarrimenti dei farmaci, perché in quel caso immediatamente le autorità sono in grado di verificare se quel tipo di farmaco con quel tipo di bollino che è nel circuito distributivo, essendo stato soggetto a furto, sia stato conservato non correttamente dopo il furto, laddove molti farmaci devono viaggiare a temperature controllate, alcuni vanno nella catena del freddo, altri che non possono superare nella conservazione temperature di un certo tipo.
Ovviamente questo sito web con cui abbiamo collaborato è gestito dall'AIFA, dai NAS, dall'Agenzia delle dogane e dalla Guardia di finanza, per avere un controllo stretto su tutto quello che entra nel nostro Paese e che è contraffatto. Abbiamo cercato di fare tutto questo in collaborazione con le autorità, con il fine ultimo di tutelare la salute dei pazienti che purtroppo devono ricorrere all'utilizzo dei farmaci, e devono utilizzare farmaci non contraffatti, che siano controllati dal momento della produzione fino all'arrivo in carico al paziente, perché c'è un processo che prevede che l'AIFA intervenga in tutti questi passaggi per garantire che il farmaco sia efficace, tollerabile, prodotto con norme di buona pratica, in accordo con tutti i protocolli per i controlli. Grazie.
PRESIDENTE. Grazie a lei, presidente. Prima di dare la parola ai colleghi a partire dal collega Paolo Russo, credo opportuno che lei faccia un rapidissimo chiarimento su un punto. Parlando della carenza del farmaco lei ha evidenziato come nel nuovo quadro normativo europeo che andrà in vigore quando tutti avranno applicato la direttiva recentemente adottata ci sarà un sistema per il quale una confezione che venga dirottata dall'Italia ad altro Paese comunitario venga riconfezionata, ma pezzo per pezzo? La direttiva quindi prevede che sia messo in una nuova scatoletta con il numero d'ordine del Paese in questione?
MASSIMO SCACCABAROZZI, presidente di Farmindustria. Sì.
PRESIDENTE. Prego, collega Russo.
PAOLO RUSSO. Intanto grazie. C'è un elemento di novità rispetto alle altre audizioni: quindi l'attuale sistema consente di monitorare e tracciare in chiave assoluta ogni confezione, quindi di ogni confezione abbiamo la tracciatura assoluta, cioè sappiamo dove è prodotto, da quale deposito proviene, a quale distribuzione sia affidato e successivamente anche a quale farmacia sia stata consegnata ogni singola confezione?
MASSIMO SCACCABAROZZI, presidente di Farmindustria. Sì, avviene per quantità, non per singola confezione, però ogni quantità di confezione ha questo bollino ottico che quando viene letto e rilevato permette di capire tutta la vita di questo farmaco: il numero di lotto, dove è stato prodotto, dove è stato distribuito. Questo è molto utile per svariati motivi, ad esempio viene utilizzato per il monitoraggio della spesa farmaceutica, ma può anche essere utile nell'eventualità che per un problema produttivo il farmaco debba essere ritirato, in quanto siamo in grado di capire dove sia finito quel lotto, quali farmacie e quali pazienti lo abbiano, e viene ritirato immediatamente.
PAOLO RUSSO. Quindi abbiamo una tracciatura per lotto.
MASSIMO SCACCABAROZZI, presidente di Farmindustria. Sì.
PAOLO RUSSO. Altra questione, sulla carenza dei farmaci. Capisco che con la nuova normativa si riconfeziona, ma immagino che, se avessimo una tracciatura per confezione, anche oggi saremmo in condizione di individuare e tracciare quali e quante di queste confezioni possano seguire una strada alternativa che, per quanto Pag. 6lecita, sottrae il prodotto al mercato nazionale.
Ultima questione. Lei ha parlato di contraffazione farmaceutica limitata nell'ordine del 5 per cento ma, se ragioniamo di miliardi di confezioni, anche il 5 per cento immagino abbia un valore di milioni di confezioni. Pensa che anche su questo si possa fare qualcosa e in che modo? Il senso della nostra iniziativa è proprio quello di recuperare dalla vostra esperienza sul campo e dal vostro osservatorio privilegiato indicazioni e soluzioni per migliorare anche la performance della norma.
MASSIMO SCACCABAROZZI, presidente di Farmindustria. Oggi il problema è che, non essendoci l'obbligo di riconfezionamento, l'esportatore parallelo deve solo annullare il bollino e quindi non c'è un sistema di monitoraggio che consenta di capire dove è finito quel farmaco, quindi viene annullato il bollino ed è finita lì. Per quanto riguarda invece la parte della contraffazione, nei canali ufficiali...
PAOLO RUSSO. Mi perdoni, quindi questo potrebbe accadere anche per una confezione rubata.
MASSIMO SCACCABAROZZI, presidente di Farmindustria. Assolutamente sì, infatti attraverso l'implementazione di Medicrime devo dire che per esempio ha fatto scalpore una grossa attività che lo scorso anno AIFA realizzò insieme ai NAS, perché in un Paese europeo furono rinvenuti importanti farmaci oncologici provenienti dall'Italia.
Grazie al sistema di monitoraggio con il bollino e grazie al fatto che nel website l'azienda aveva pubblicato tutti i dati di furto e di smarrimento si è capito che provenivano da un mercato illegale, perché spesso vengono sequestrati i mezzi che li trasportano e i farmaci vengono rubati ed esportati all'estero. Attraverso Medicrime AIFA e i NAS riuscirono a smantellare questa organizzazione e ad evitare che il farmaco venisse utilizzato.
Oggi, infatti, dalla produzione alla distribuzione, a quando arriva in farmacia e poi in ospedale, dove comunque è sottoposto alle norme di conservazione previste dalla legge, il farmaco è estremamente controllato, ma, se un farmaco viene rubato, da quel momento in poi non sappiamo come viaggi, a che temperatura e a quale livello di umidità venga conservato, e questo è un problema.
Per quanto riguarda invece il discorso dei farmaci contraffatti, praticamente il problema nei canali ufficiali non esiste, perché noi non possiamo distribuire se non alle farmacie, ai grossisti autorizzati o agli ospedali. Tutto quello che può essere contraffatto si trova negli acquisti che si fanno nei siti internet e noi non possiamo distribuire nei siti internet, quindi quello che si trova lì dentro non arriva dai canali ufficiali, può arrivare dai canali non ufficiali.
Anche questo a luglio dello scorso anno fu regolamentato attraverso la possibilità di alcune farmacie di vendere online, però queste farmacie devono essere autorizzate dal Ministero della salute e l'utente può verificare nel web se quella farmacia sia autorizzata o meno.
Il grosso problema della contraffazione, come ci dicono i NAS quando lavoriamo con AIFA e Medicrime, deriva dagli acquisti che si fanno via web.
PRESIDENTE. Grazie, presidente. Vorrei tornare rapidamente sulla prima questione sollevata dal collega relatore Paolo Russo in merito alla tracciatura del sistema. Noi avevamo capito che non esistesse un sistema di tracciatura, nemmeno per lotto, nel senso che abbiamo il momento dell'uscita dalla fabbrica in cui c'è una fotografia della partita del lotto, poi abbiamo un altro momento più a valle, che è quello in cui le farmacie vendono al consumatore finale e comunicano ai fini del sistema del MEF sulla spesa la vendita di quel pezzo, quindi quello che avviene in mezzo lo possiamo ricostruire a posteriori, risalendo per vedere quella confezione o quel lotto che strada abbia fatto, ma non c'è un sistema – mi corregga se sbaglio – che oggi impone a tutti i grossisti che si trovino in mezzo alla sequenza di comunicare a una banca dati il movimento del lotto, perché questo vorrebbe dire tracciatura per lotto, anche se non per confezione. Pag. 7
Abbiamo un sistema dove possiamo ricostruire ex post i passaggi del prodotto o c'è una vera tracciatura, in cui in ogni passaggio si comunica a una banca dati il movimento del lotto o della confezione?
MASSIMO SCACCABAROZZI, presidente di Farmindustria. La possibilità c'è, perché il farmaco esce dall'azienda produttrice con il bollino ottico, che viene prodotto dal Poligrafico dello Stato. L'azienda acquista il bollino dal Poligrafico dello Stato, deve ovviamente dichiarare la quantità di farmaco che esce perché ci sia congruità tra i volumi e i bollini acquistati, viene apposto sulla confezione ed esce con il bollino che ha la lettura ottica.
Si può quindi tracciare, ma il problema è che non viene rispettato nei canali successivi. Se fosse previsto che ognuno faccia la tracciatura, si potrebbe fare perché il bollino sul farmaco c'è e l'apposizione del bollino avviene nel momento in cui il farmaco viene prodotto.
Quindi, anche quando si tratta di mettere in commercio un nuovo farmaco, dal momento in cui l'autorizzazione alla vendita del farmaco viene pubblicata sulla Gazzetta Ufficiale l'azienda fa la richiesta dei bollini al Poligrafico, che li stampa, li manda all'azienda, li appone sulla scatoletta e vengono poi distribuite le confezioni. La possibilità di farlo c'è, volendo. Oggi però non so se sia previsto dalla legge, ma non si fa.
PRESIDENTE. Bene, a questo punto abbiamo avuto conferma che abbiamo un sistema che consente ex post di riavere la sequenza, ma in questo momento non c'è una tracciatura in essere con una banca dati che ci sappia dire in qualsiasi momento dove sia quel lotto e che passaggi abbia fatto.
FRANCO BORDO. Solo per approfondire questo punto: sinceramente non ho capito se questo non avvenga a causa di un buco normativo.
MASSIMO SCACCABAROZZI, presidente di Farmindustria. Perché a livello della distribuzione non viene rilevato dove il distributore porti questo farmaco, però ex post si potrebbe fare perché, se il farmaco viene trovato ad esempio in Inghilterra e il bollino c'è ancora, noi siamo in grado di capire da dove arrivi e chi abbia comprato quel lotto, dove siano quelle 50 o 200 confezioni che fanno parte di quella bollinatura.
FRANCO BORDO. Il fatto di non farlo è una violazione o no?
MASSIMO SCACCABAROZZI, presidente di Farmindustria. Questo non lo so perché non ci riguarda, ma credo di sì.
MARIA GRAZIA CHIMENTI, responsabile Area Gruppi specifici, Spesa farmaceutica, Rapporti con le associazioni di filiera. La norma c'è, è previsto che venga fatto, il numero del lotto dovrebbe essere trasmesso. Il problema è che a livello di distribuzione, quindi grossisti, si sono opposti a questa norma e a questa regola che ha ribadito anche il Ministero della salute, perché dicono che non tutti sono in grado di mandare questo dato che le aziende farmaceutiche inviano, perché rispettano quanto la norma prevede, ma a livello di distribuzione non c'è ancora questa possibilità.
Si sono opposti, di fatto non lo fanno, quindi questo non chiude il giro punto per punto. Ovviamente all'indietro riusciamo a ricostruirlo perché noi, oltre ad inviare puntualmente le informazioni, inviamo anche il range di bollini che utilizziamo. Li inviamo al Ministero della salute e, siccome sono progressivi, dichiariamo di utilizzare dall'1 al 100, quindi se trovano un bollino che è fuori dal 100, vuol dire che quel farmaco non è stato prodotto dall'azienda.
PRESIDENTE. Ricordo a me stesso e a tutti voi che quanto la dottoressa ha detto coincide totalmente con quanto ci aveva detto la rappresentante del Ministero della salute, nel senso che, nel tentativo di applicare alcuni anni fa questa normativa, si è andati incontro a delle oggettive resistenze da parte dei grossisti, che hanno Pag. 8manifestato difficoltà nella praticabilità della norma.
PAOLO RUSSO. Ricordo infatti la difficoltà nell'applicabilità tecnica e l'azione derogatoria, perché in ragione della norma poi c'è stata anche un'azione derogatoria.
PRESIDENTE. Parliamo di norme non a livello di legge, ma sub primarie che, proprio perché era emersa questa difficoltà da parte dei grossisti, furono poi derogate come ricorda il collega Russo, non ricordo se con circolare o con decreto del Ministero della salute.
Ringrazio i nostri ospiti e dispongo che la documentazione prodotta sia pubblicata in allegato al resoconto stenografico della seduta odierna.
Audizione del Direttore del Centro di Ricerca in Farmacoeconomia e Farmacoutilizzazione CIRFF Ettore Novellino.
PRESIDENTE. L'ordine del giorno reca, nell'ambito dell'approfondimento tematico in materia di contrasto della contraffazione nel settore farmaceutico, l'audizione del direttore del Centro di Ricerca in Farmacoeconomia e Farmacoutilizzazione CIRFF, Ettore Novellino, a cui cedo la parola.
ETTORE NOVELLINO, direttore del Centro di Ricerca in Farmacoeconomia e Farmacoutilizzazione CIRFF. Io ho esaminato l'oggetto della convocazione, il contrasto alla contraffazione nel settore farmaceutico. Innanzitutto, siccome mi interesso dell'analisi di tutta la spesa farmaceutica che si forma principalmente in regione Campania ma anche nelle altre regioni d'Italia, la cosa evidente è che nei canali legali della distribuzione del farmaco, quindi in tutta la filiera, i fenomeni di contraffazione sono veramente pochi, e, più che di contraffazione in termini di qualità di farmaco potremmo parlare di canali paralleli di distribuzione, però sempre di farmaci che hanno tutti quanti i requisiti richiesti per l'immissione in commercio, quindi sicurezza ed efficacia terapeutica.
Il problema invece si pone da un po’ di tempo a questa parte per la possibilità di acquisto dei farmaci online sia attraverso i canali autorizzati, sia attraverso i canali non autorizzati, intendo canali autorizzati residenti su siti italiani e canali non autorizzati residenti su siti in tutto il mondo, dove tramite il web è facile intervenire.
Il problema che si sta ponendo, che noi abbiamo anche considerato dal punto di vista sperimentale, è che questi farmaci contraffatti, che vengono propagandati con un prezzo irrisorio rispetto al prezzo reale di vendita in Italia, spesso non contengono affatto il principio attivo oppure contengono principi attivi prodotti in Paesi dove le norme di GMP (good manufacturing practices, norme di buona preparazione) non esistono proprio o sono a maglie abbastanza larghe, motivo per cui viene inserito il principio attivo però non con la debita purezza, ma con tutta una serie di contaminanti da reazioni di preparazione, che spesso danno seri effetti di tossicità nella persona che assume questo tipo di farmaci.
Il problema quindi riguarda questo tipo di canale. Quali possono essere i suggerimenti sinceramente non spetta a me individuare, però voglio fare solo questa riflessione: esiste una filiera di distribuzione (industria, distribuzione intermedia, farmacie) che finora ha sempre garantito la qualità di ciò che veniva distribuito; ma, oltre a garantire la qualità di ciò che viene distribuito, c'è anche la responsabilità oggettiva di ciò che viene distribuito, questo discorso bisognerebbe implementarlo anche a livello di quelle che sono le vendite online, impedendo le vendite che arrivano dall'estero, perché in genere questi siti online dall'estero sono tutti localizzati in India o in Cina. Bisognerebbe quindi consentire le vendite online solo a strutture italiane che siano autorizzate (il Ministero della salute autorizza determinati distributori a questo tipo di vendita), richiedendo a queste strutture i requisiti di garanzia che vengono richiesti nella normale filiera di distribuzione.
Che cosa intendo aggiungere a questo punto? Oltre che della qualità del farmaco stesso, a cui facevo cenno prima, bisogna Pag. 9tener conto anche delle norme di buona conservazione del farmaco (catena del freddo, determinati accorgimenti) che nella filiera normale di distribuzione è rispettata in maniera rigorosa, mentre in una filiera online, anche se la vogliamo limitare al discorso controllato in un determinato modo, possiamo controllare la qualità del farmaco stesso, ma certamente non possiamo controllare le modalità adottate nel corso della distribuzione e della vita di questo farmaco per conservarne l'integrità in funzione di possibili problemi di temperature o di trasporto.
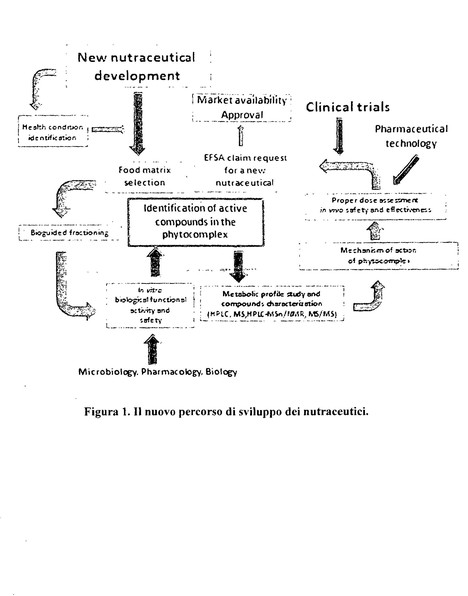
Ci stiamo preoccupando molto del discorso farmaco, ma vorrei porre alla vostra attenzione un'altra problematica, quella degli integratori alimentari, che hanno preso un enorme spazio soprattutto negli ultimi anni. Mentre la spesa per farmaci a livello nazionale, comprendendo Sistema sanitario nazionale, farmaci ospedalieri, farmaci di fascia C pagati dal cittadino, si aggira intorno ai 15-20 miliardi di euro, il mercato degli integratori alimentari ha raggiunto come volumi i 200 milioni di pezzi e come fatturato i 150 milioni di euro, il che significa che è un mercato in crescita.
Sta venendo fuori un discorso di appetibilità di questi farmaci perché dal 1950 in poi, con le acquisizioni del mondo della medicina e della scienza, siamo riusciti non solo a curare le malattie, ma anche ad incrementare in modo rilevante l'età media di vita, perché negli anni ’70 in Italia l'età media era 65 anni (non per niente si andava in pensione a 60 e uno aveva giusto 5 anni di tempo medi per prepararsi all'aldilà), oggi abbiamo un'età media di 85 anni.
Questo significa che tutto il periodo post-lavorativo determina una richiesta non solo di salute nel senso di controllo e assenza delle malattie, cosa che riusciamo a fare bene con i farmaci, ma anche una grossa richiesta di benessere psicofisico e di apparire belli per poter avere un ruolo e non essere decrepiti in una società che si fonda su determinati valori.
Tutta questa richiesta attualmente sfugge al controllo scientifico, alla rigorosità della sicurezza e di efficacia di eventuali rimedi, e sta in questo limbo degli integratori alimentari, dove non esiste una effettiva regolamentazione. Se infatti voglio mettere in commercio un integratore alimentare, basta che prendo un po’ di piante senza neppure averne controllato l'origine in termini di tipo di coltivazione, presenza di antiparassitari, presenza di erbicidi, li mescolo insieme, comunico al Ministero della salute che sto per immettere sul mercato questo integratore, se dopo 60 giorni il Ministero della salute non mi dà il diniego, lo posso commercializzare.
Viene fuori quindi il discorso degli integratori alimentari antitumorali, degli integratori alimentari per l'Alzheimer, degli integratori alimentari per il Parkinson, cioè ognuno promette salute, ma è una promessa quasi mai mantenuta. Ribadisco spesso infatti che questi integratori fanno bene a chi li produce e li vende, ma certamente non a chi li utilizza.
A questo punto, sempre sul tema contraffazione allargata dal punto di vista di tutela del cittadino e ciò che spende sarebbe opportuno prevedere una regolamentazione per la registrazione anche degli integratori alimentari, seguendo un percorso simile a quello dei farmaci, anche se alleggerito, dove bisogna conoscere ciò che dal punto di vista molecolare è presente nell'integratore per capire se effettivamente possa avere un'efficacia terapeutica, se possa presentare rischi ed effetti collaterali e soprattutto se possa essere dimostrata efficacemente una certa efficacia nell'assunzione di questo integratore.
È un problema che io mi sono posto come centro, vi ho portato un'analisi in questo dossier che lascio agli atti della Commissione. Vi faccio anche una proposta di regolamentazione di quello che dovrebbe essere il percorso che questi integratori alimentari o nutraceutici, come oggi li si chiama con un termine molto più accattivante, dovrebbero seguire per poter garantire sicurezza. Consegno anche un mio lavoro in cui analizzo tutta la problematica e propongo delle soluzioni.
Tecnicamente il discorso della filiera, il discorso della buona conservazione e dei vari passaggi di un farmaco dall'azienda Pag. 10produttrice ai vari distributori, alle varie farmacie, ai vari utilizzatori oggi potrebbe servirsi di quella tecnologia con il tag che si mette sullo scatola e sul bollino e quello illustrerebbe tutti i momenti dall'uscita a chi l'ha utilizzato già sulle confezioni. Oltre al codice AEC esiste un codice univoco di targatura per ciascuna confezione, però la SOGEI ancora non lo acquisisce, quindi è qualcosa che sta lì e potrebbe già indicare le truffe, perché acquisire quel codice significa bruciare quel bollino e non permetterne più il riutilizzo.
Per quanto riguarda quindi i vari movimenti, esportazioni parallele, scambi, questo codice tag che può essere letto in radiofrequenza quindi non è un impegno gravoso per l'industria e gli operatori potrebbe permettere di tracciare il tutto da quando nasce a dove va buttato.
PRESIDENTE. Grazie, direttore, ci ha ricordato alcuni aspetti salienti del tema della tracciabilità, ma ci ha dato anche questa interessante suggestione sugli integratori alimentari. Devo dire che è un po’ ai limiti del perimetro dell'attività della Commissione, però rimetto una valutazione definitiva al riguardo al relatore, che esaminerà la documentazione e rifletterà sulle cose che lei ha detto in materia.
Lascio la parola ai colleghi che desiderino intervenire per porre quesiti o formulare osservazioni.
PAOLO RUSSO. Grazie, presidente. Ringrazio il direttore per averci fornito un'utile sollecitazione di tipo scientifico, che obiettivamente è proprio al confine, quindi valuteremo con il conforto del presidente e dei colleghi. Vorrei capire meglio cosa intenda con codice in radiofrequenza, una tecnologia che consente la tracciatura? Abbiamo capito infatti che è tutto tracciato ex post, nel senso che l'azienda farmaceutica trasferisce il lotto e sa a chi va, lotto per lotto ma non confezione per confezione, sino alla farmacia.
Ovviamente ex post è possibile una riconducibilità, ma una tracciatura durante il processo non esiste, ma questa radiofrequenza consentirebbe di fare un'operazione online tipo telepass?
ETTORE NOVELLINO, direttore del Centro di Ricerca in Farmacoeconomia e Farmacoutilizzazione CIRFF. Innanzitutto diciamo che i lotti che un'industria produce hanno numerosità molto elevate, quindi non possono andare in un unico canale della filiera intermedia, ma vengono ripartiti fra più filiere intermedie. Ogni singola confezione ha un numero univoco, che fa il paio con il lotto, però dovrebbe essere acquisito manualmente perché sono numeri arabi posti sulla scatola.
Quello che suggerivo è un sistema poco costoso, perché stiamo parlando di un centesimo a tag, che potrebbe essere messo sulla confezione nella fase di allestimento e passando tipo telepass sotto un lettore ogni scatola manderebbe il suo segnale, quindi non ci sarebbero tempi tecnici e costi aggiuntivi, però questo permetterebbe di tracciare passaggio per passaggio. Si eviterebbero anche i furti dei camion, perché sarebbero tutti individuabili in radiofrequenza.
PRESIDENTE. Quest'ultimo scenario che lei ha delineato con questo tag è una tecnologia di cui lei ha percezione, conoscenza ed esperienza?
ETTORE NOVELLINO, direttore del Centro di Ricerca in Farmacoeconomia e Farmacoutilizzazione CIRFF. Diretta no, conoscenza sì, ho già inserito qualcosa in questo fascicolo e, se vi interessa, posso approfondire e portarvi anche una progettualità da questo punto di vista.
PRESIDENTE. La ringrazio, è probabile che ci si torni.
PAOLO RUSSO. A me sembra (ma la mia ignoranza è tale da far impallidire chiunque) che nelle criticità che individuiamo questo sarebbe un elemento risolutorio, però sarebbe utile avere ulteriori elementi per approfondirlo.
PRESIDENTE. Senza dubbio, perché l'idea che partite importanti con migliaia di confezioni possano essere effettivamente tracciate con un passaggio che dura pochi Pag. 11secondi, attraverso una macrostruttura che legge insieme migliaia di pezzi, è indubbiamente uno scenario che rende più vicina la possibilità di arrivare a un vero sistema tracciato passaggio dopo passaggio.
Ricordo che abbiamo in programma una giornata seminariale sui sistemi di tracciabilità che stiamo cercando di organizzare per aprile prossimo, in cui si potrebbe inserire anche questo ragionamento.
La ringraziamo molto, direttore. Dispongo che la documentazione prodotta sia pubblicata in allegato al resoconto stenografico della seduta odierna.
Audizione di rappresentanti dell'Associazione Distributori Farmaceutici ADF.
PRESIDENTE. L'ordine del giorno reca, nell'ambito dell'approfondimento tematico in materia di contrasto della contraffazione nel settore farmaceutico, l'audizione di rappresentanti dell'Associazione Distributori Farmaceutici ADF. Sono presenti il dottor Roberto Porcelli, consigliere dell'Associazione distributori Farmaceutici ADF, il dottor Walter Farris, direttore generale dell'Associazione distributori Farmaceutici ADF, il dottor Giuseppe Scrofina, delle Relazioni esterne dell'Associazione distributori Farmaceutici ADF, e il dottor Crescenzo Cinquegrana.
Lascio quindi la parola al Direttore generale dell'Associazione distributori Farmaceutici ADF, Walter Farris.
WALTER FARRIS, Direttore generale dell'Associazione distributori Farmaceutici ADF. Grazie, presidente. Grazie di questo invito su un tema veramente molto delicato, che certamente coinvolge la nostra categoria e il lavoro che quotidianamente svolgiamo nell'interesse del cittadino attraverso la nostra capillare rete di siti logistici che servono quotidianamente le farmacie del nostro territorio.
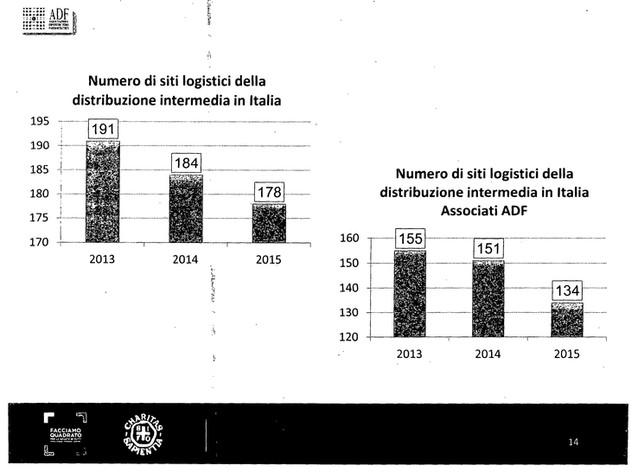
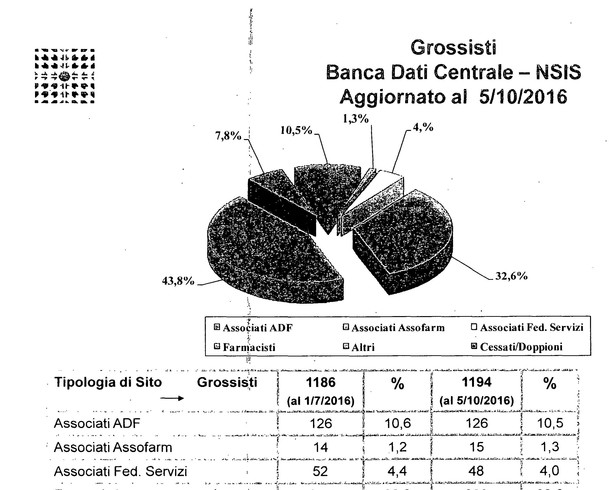
Noi rappresentiamo come associazione di categoria i due terzi dei distributori presenti nel territorio nazionale, abbiamo 140 siti logistici, immaginate che mentre stiamo parlando in Italia circolano circa 6.000 mezzi di trasporto coibentati, refrigerati, che tengono conto delle necessità di trasporto del farmaco, quindi catena del freddo, temperature controllate e monitorate, e facciamo circa 90.000 consegne al giorno alle farmacie, quindi immaginate la mole di lavoro che svolgiamo nella velocità.
Qui parliamo di contraffazione, tema in cui la fase dei controlli è fondamentale, quindi ciò che auspichiamo è che in futuro i controlli che dovremo fare saranno in linea con le operatività che noi abbiamo in questo momento.
PRESIDENTE. A questo punto passiamo la parola al dottor Porcelli. Intanto abbiamo distribuito il materiale prodotto dall'associazione.
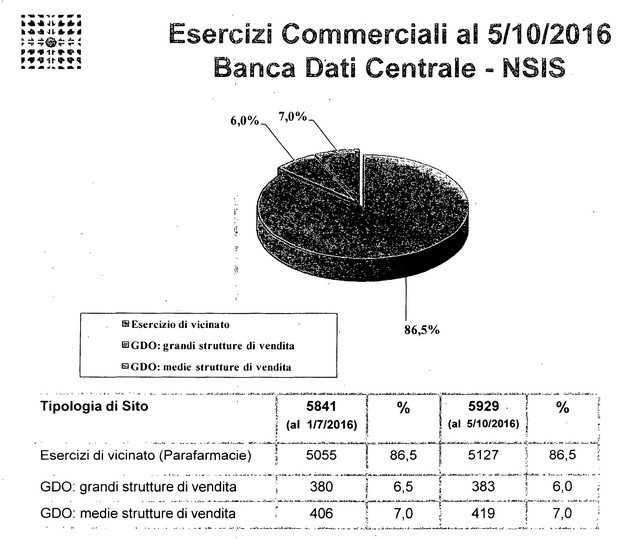
ROBERTO PORCELLI, consigliere dell'Associazione distributori Farmaceutici ADF. Buongiorno a tutti. Grazie di questa opportunità per poter condividere con voi le caratteristiche dell'attività logistica della distribuzione del farmaco, in particolare della categoria che rappresentiamo oggi, definita dei distributori intermedi full-line. La distinzione tra full-line e short line è importante, anche perché il servizio dei distributori full-line che erogano alle farmacie è quello che caratterizza la fornitura anche al consumatore, al paziente finale del farmaco in tempo quasi reale.
Noi distributori consegniamo circa quattro volte al giorno alle farmacie i prodotti che quotidianamente ognuno di noi va nella farmacia ad acquistare. Il farmaco è una delle tante categorie di prodotti che noi trattiamo all'interno dei nostri magazzini, ogni magazzino di distribuzione intermedia oggi tratta mediamente 90-100.000 referenze. È questo il motivo per cui definiamo full-line, perché andiamo a rifornire le farmacie di tutto quello di cui hanno bisogno. Il farmaco è l'elemento più importante e rappresenta una delle categorie che ovviamente devono essere soggette a maggior controllo.
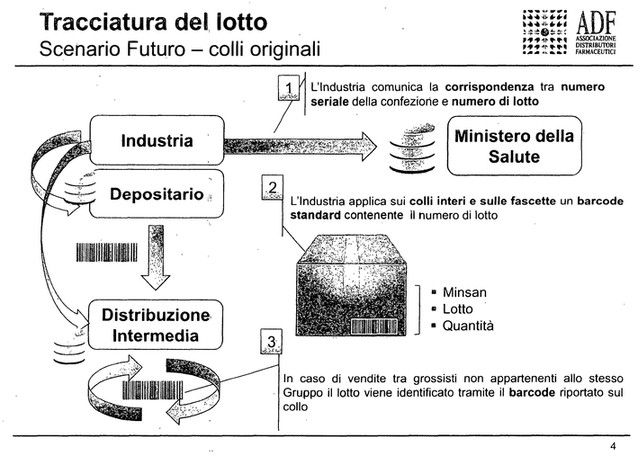
In tema di controllo oggi siamo in una fase di transizione, perché la normativa sull'anticontraffazione, la direttiva europea del 2011, ha emanato una serie di atti delegati a livello europeo, che prevedono Pag. 12una sorta di allineamento in tema di tracciatura del lotto del prodotto trattato e della singola scatoletta, il codice di targatura, che consente al consumatore finale di esser certo che il prodotto che si sta andando a dispensare è esattamente il prodotto immesso nella catena distributiva a livello europeo dai produttori.
Questa normativa è in fase di attuazione in tutti i Paesi europei e prevede oggi un concetto di tracciatura cosiddetto end to end. La direttiva andava a definire un concetto importante, ovvero di proporzione tra gli investimenti necessari per gli attori della filiera per adeguarsi a queste nuove direttive rispetto all'efficacia che tali interventi potevano avere come valore aggiunto sulla catena distributiva.
La tracciatura è stata quindi definita end to end, ovvero tracciatura del prodotto della singola scatoletta nell'immissione nella catena distributiva ad opera dei distributori, e tracciatura ad opera dei farmacisti nella dispensazione finale dei prodotti farmaceutici. Il farmaco viene così «matchato», una volta dispensato al cittadino, all'interno di un database con il codice del singolo prodotto, della singola scatoletta con cui è stato immesso nella catena distributiva dal produttore.
I distributori intermedi in questa filiera avranno l'importante compito di tracciare il singolo prodotto farmaceutico che non è distribuito in maniera verticale, ovvero quelli che possono essere acquisti fatti da altri grossisti e quelli che possono essere i resi da farmacia, perché alcuni prodotti che non vengono dispensati al cittadino per varie motivazioni vengono poi resi al grossista.
In questa che è una fase orizzontale nella catena distributiva, il distributore avrà l'obbligo di tracciare, attraverso una scannerizzazione di un codice definito datamatrix che contiene molte informazioni aggiuntive rispetto a quello che oggi è contenuto nel cosiddetto «bollino», tutto ciò che entra nella sua catena distributiva e verificare se anche quei prodotti che sono stati distribuiti in maniera orizzontale siano esattamente coerenti con i codici immessi nella catena distributiva dal produttore. Tutto questo è a livello europeo.
In termini di tempistica la direttiva riconosce ai Paesi dell'Unione la possibilità di adeguarsi in tre anni dall'emissione degli atti delegati che hanno circa un anno, quindi nel 2019 i Paesi europei avranno l'obbligo di attuare questa nuova organizzazione di tracciatura dei prodotti farmaceutici, per l'Italia è prevista invece un'estensione di questo periodo di altri 6 anni e quindi in Italia l'obbligo è previsto per il 2025, forti del fatto che in Italia un sistema di tracciatura e di controllo del farmaco è già presente.
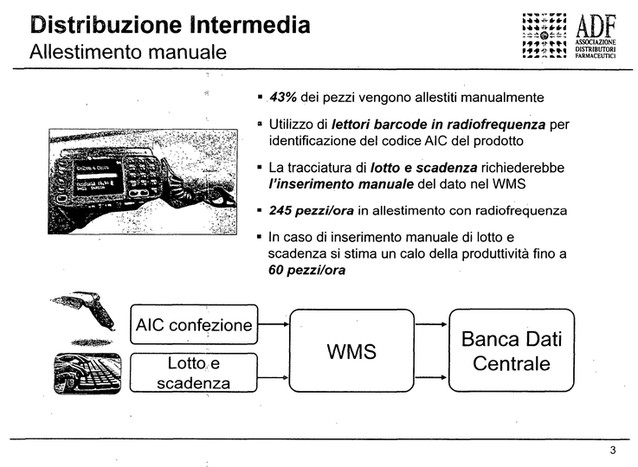
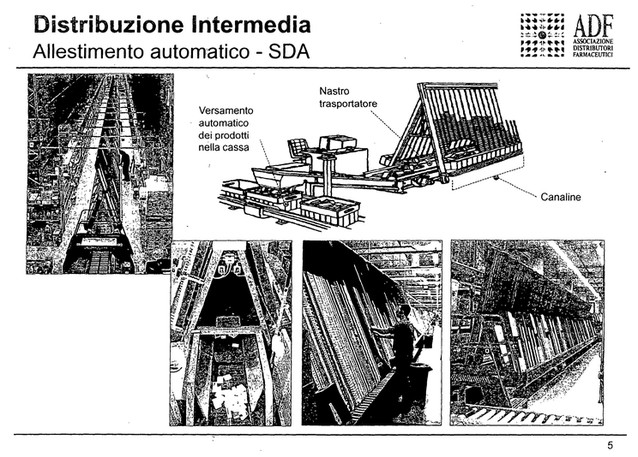
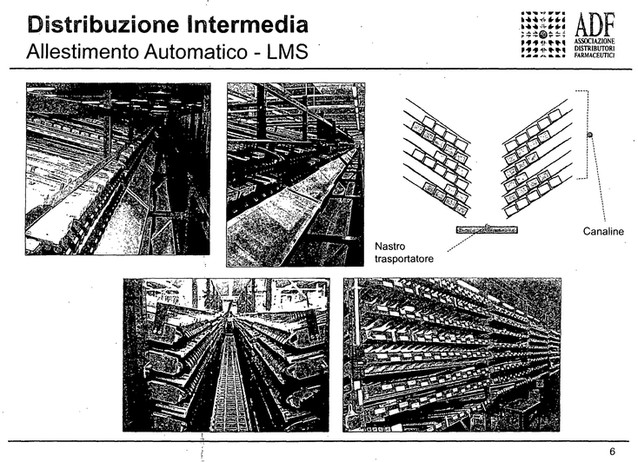
Perché questo è stato definito un intervento coerente? Perché la tracciatura in uscita dei singoli prodotti, delle singole scatolette di farmaci ad opera di distributori intermedi sarebbe un onere economico molto importante, perché il 60-65 per cento dei pezzi che un distributore intermedio eroga alle farmacie è erogato con sistemi di allestimento automatico, che non prevedono l'intervento dell'uomo. Il prodotto viene inserito all'interno di una canalina e durante l'allestimento viene erogato automaticamente da un sistema, quindi in questa fase nessun uomo interviene e non ci sarebbe la possibilità quindi di verificare il singolo codice presente sulla scatola.
L'unico momento in cui è possibile farlo è nella fase dell'ingresso e per questo nei cosiddetti «acquisti orizzontali» è stato prescritto per i distributori intermedi l'obbligo di tracciare l'ingresso. Noi abbiamo l'obbligo di distribuire i farmaci in tutte le farmacie del territorio per legge nelle 12 ore, ma in realtà per garantire un servizio molto capillare e molto rapido noi serviamo le farmacie con un lead time medio, un tempo dall'ordine alla consegna in farmacia, di due ore, ma può andare da un minimo d un'ora e mezza in alcune fasce orarie ad un massimo di quattro ore durante altre fasce orarie.
PRESIDENTE. Ringrazio gli auditi e cedo la parola al relatore, Paolo Russo.
PAOLO RUSSO. Grazie. Il quadro si va componendo esattamente come noi abbiamo Pag. 13 compreso anche nelle precedenti audizioni. In buona sostanza, quindi, voi prendete in carico un lotto e vi è una riconducibilità di questo lotto facendo una valutazione ex post anche sulla singola confezione, ma – se capisco bene, mi aiuti a comprendere – dal distributore sappiamo il numero delle confezioni di antibiotico, ma non sappiamo esattamente quali confezioni vadano alla farmacia, e questo presumibilmente perché immagino movimentiate milioni di pezzi al giorno, quindi soprattutto in ragione di un deficit organizzativo-tecnologico, in quanto non esiste un lettore in grado di leggere milioni di pezzi al giorno.
Questo è l'elemento di criticità. Sa se esistono altre tecnologie in grado di agevolare questo processo di tracciabilità assoluta, in modo tale che il produttore del farmaco monitori confezione per confezione, trasmettendo i dati ad una banca dati, e a vostra volta, quando trasferite alle singole farmacie possiate assumere una tracciabilità totale?
ROBERTO PORCELLI, consigliere dell'Associazione distributori Farmaceutici ADF. La mole di movimentazione è corretta, parliamo di una decina di milioni di pezzi che vengono erogati dai distributori intermedi. In termini di tecnologie attuali, con le caratteristiche di packaging che abbiamo sui prodotti che movimentiamo, ad oggi non esiste una tecnologia di lettura che ci consenta di avere in diretta queste informazioni.
PAOLO RUSSO. Quindi nemmeno in radiofrequenza, tipo telepass?
ROBERTO PORCELLI, consigliere dell'Associazione distributori Farmaceutici ADF. Lei forse intende l'RFID? Faccio questa precisazione tecnica non per correggerla, ma per dare una maggiore precisazione di quello che è l'ambito di cui stiamo parlando.
L'RFID è una tecnologia che sicuramente consentirebbe una velocità di lettura, perché non è soggetta alla lettura fisica di un codice a barre, bidimensionale o monodimensionale che sia, perché si basa sulla lettura via radio dei chip (definiamoli così per semplicità) che devono però essere allocati sui prodotti o su quello che deve essere letto. Ad oggi, non ci sono chip che si possano connettere via radio con un eventuale lettore. Tutto ciò che avviene oggi si basa su una lettura di un codice a barre, ad oggi codice a barre monodimensionale, quindi quello con le barrette verticali che conosciamo.
In futuro, grazie all'introduzione e all'attuazione dei cosiddetti atti delegati della direttiva europea, il codice sarà bidimensionale, un quadratino stampato sulle confezioni dei farmaci, che conterrà maggiori informazioni, quindi con una scannerizzazione manuale che comunque prevederà sempre la presenza di un uomo che faccia questa operazione, si potranno avere maggiori informazioni. È chiaro che questo non aiuta la fase di erogazione indiretta dei prodotti allestiti con impianti automatici, perché lì l'uomo non interviene.
PAOLO RUSSO. In buona sostanza la normativa europea ci aiuterà a fare alcuni passaggi e alcune chiarezze, ma lascerà sostanzialmente intatto questo aspetto.
ROBERTO PORCELLI, consigliere dell'Associazione distributori Farmaceutici ADF. Dal punto di vista della finalità, la normativa europea aiuta ad impedire che un farmaco contraffatto possa finire nelle mani di un cittadino, quindi di un paziente, perché prima dell'erogazione questo codice scannerizzato manualmente dal farmacista andrà ad interfacciarsi con un sistema che conterrà l'elenco dei singoli prodotti e delle singole scatolette che sono state prodotte e messe sul mercato da soggetti autorizzati.
La finalità della normativa europea è quella di impedire che vada nelle mani del cittadino, e devo dire che con questo intervento riesce a farlo, garantendo comunque una sostenibilità economica di quelli che saranno gli investimenti necessari per la nostra categoria.
PAOLO RUSSO. Ma voi in quanto parte intermedia continuerete a leggere per lotti e non per singola confezione?
Pag. 14ROBERTO PORCELLI, consigliere dell'Associazione distributori Farmaceutici ADF. Nella fase di acquisizione del prodotto, per quei prodotti che acquisteremo da altri grossisti o da soggetti diversi dal produttore, andremo noi a scannerizzare la singola confezione e avremo l'informazione della singola confezione e non del lotto. In fase di erogazione verso la farmacia ovviamente non potremo tracciare nulla, perché richiederebbe degli investimenti enormi, però la farmacia potrà evitare che vada al cittadino finale il prodotto contraffatto.
PRESIDENTE. Il tema è delicatissimo e, come avrete compreso, siamo molto concentrati sul tema tracciabilità, tracciatura o riconoscibilità ex post di un processo. Sono cose ben diverse, però abbiamo compreso che allo stato c'è una forte difficoltà tecnica a realizzare una vera tracciatura per confezione, perché, se è necessario un intervento umano su ogni singola confezione, questo è difficilmente realizzabile.
Ringrazio i nostri ospiti e dispongo che la documentazione prodotta sia pubblicata in allegato al resoconto stenografico della seduta odierna.
La seduta termina alle 15.30.
Pag. 15ALLEGATO