Resoconto dell'Assemblea
XVII LEGISLATURA
TESTO AGGIORNATO AL 27 MAGGIO 2014
COMUNICAZIONI
Missioni valevoli nella seduta del 28 aprile 2014.
Angelino Alfano, Gioacchino Alfano, Alfreider, Alli, Amendola, Amici, Attaguile, Baldelli, Baretta, Bellanova, Dorina Bianchi, Bindi, Biondelli, Bobba, Bocci, Michele Bordo, Borletti Dell'Acqua, Boschi, Brescia, Bressa, Brunetta, Bruno Bossio, Caparini, Capezzone, Casero, Causin, Cicchitto, Cirielli, Costa, D'Ambrosio, D'Uva, Dambruoso, Damiano, De Girolamo, Del Basso De Caro, Dellai, Di Gioia, Di Lello, Luigi Di Maio, Epifani, Fava, Ferranti, Fico, Gregorio Fontana, Fontanelli, Formisano, Fraccaro, Franceschini, Galan, Garavini, Gasbarra, Giachetti, Giacomelli, Giancarlo Giorgetti, Legnini, Leone, Lorenzin, Lotti, Lupi, Madia, Magorno, Mannino, Giorgia Meloni, Merlo, Meta, Migliore, Mogherini, Orlando, Pes, Gianluca Pini, Pisicchio, Pistelli, Ravetto, Realacci, Ricciatti, Andrea Romano, Rossi, Sani, Scalfarotto, Schullian, Scopelliti, Sereni, Sisto, Speranza, Tabacci, Tidei, Valeria Valente, Vecchio, Velo, Vito, Vignali, Zanetti.
(Alla ripresa pomeridiana della seduta).
Angelino Alfano, Gioacchino Alfano, Alfreider, Alli, Amendola, Amici, Attaguile, Baldelli, Balduzzi, Baretta, Bellanova, Dorina Bianchi, Bindi, Biondelli, Bobba, Bocci, Boccia, Bonavitacola, Michele Bordo, Borletti Dell'Acqua, Boschi, Brambilla, Brescia, Bressa, Brunetta, Bruno Bossio, Caparini, Capezzone, Casero, Castiglione, Causin, Cicchitto, Cirielli, Costa, D'Ambrosio, D'Uva, Dambruoso, Damiano, De Girolamo, Del Basso De Caro, Dellai, Di Gioia, Di Lello, Luigi Di Maio, Epifani, Fava, Ferranti, Fico, Gregorio Fontana, Fontanelli, Formisano, Fraccaro, Franceschini, Galan, Garavini, Gasbarra, Giachetti, Giacomelli, Giancarlo Giorgetti, La Russa, Legnini, Leone, Lorenzin, Lotti, Lupi, Madia, Magorno, Mannino, Giorgia Meloni, Merlo, Meta, Migliore, Mogherini, Orlando, Pes, Gianluca Pini, Pisicchio, Pistelli, Ravetto, Realacci, Ricciatti, Andrea Romano, Rossi, Sani, Scalfarotto, Schullian, Scopelliti, Sereni, Sisto, Speranza, Tabacci, Tidei, Valeria Valente, Vecchio, Velo, Vignali, Vito, Zanetti.
Assegnazione di progetti di legge a Commissioni in sede referente.
A norma del comma 1 dell'articolo 72 del Regolamento, i seguenti progetti di legge sono assegnati, in sede referente, alle sottoindicate Commissioni permanenti:
II Commissione (Giustizia):
MAZZIOTTI DI CELSO ed altri: «Modifiche al codice civile e al decreto legislativo 27 gennaio 2010, n. 39, concernenti le disposizioni penali in materia di società e consorzi» (1527) Parere delle Commissioni I, VI e XIV;
CAMPANA ed altri: «Modifiche al codice civile e alle disposizioni per la sua attuazione, concernenti il rafforzamento dell'amministrazione di sostegno e la soppressione degli istituti dell'interdizione e dell'inabilitazione» (1985) Parere delle Commissioni I, V, VI (ex articolo 73, comma 1-bis, del Regolamento, per gli aspetti attinenti alla materia tributaria), X e XII;
GARAVINI: «Modifiche al codice di procedura penale e altre disposizioni concernenti l'istituzione di squadre investigative comuni sovranazionali, in attuazione della decisione quadro 2002/465/GAI del Consiglio, del 13 giugno 2002» (2055) Parere delle Commissioni I, III, V e XIV;
FERRANTI ed altri: «Modifiche al codice civile e al codice penale e altre disposizioni per la prevenzione e la repressione della corruzione e dell'illegalità nella pubblica amministrazione e nei rapporti tra privati» (2165) Parere delle Commissioni I, V, VI e X.
IV Commissione (Difesa):
DURANTI ed altri: «Disciplina della rappresentanza sindacale del personale delle Forze armate e dei corpi di polizia ad ordinamento militare» (1993) Parere delle Commissioni I, II, V, XI, XII e della Commissione parlamentare per le questioni regionali;
D'ARIENZO: «Riforma della rappresentanza militare» (2097) Parere delle Commissioni I, II, V, VI, XI e XII.
V Commissione (Bilancio):
LAURICELLA ed altri: «Disposizioni per la promozione dell'impiego dei fondi strutturali dell'Unione europea da parte delle regioni» (2246) Parere delle Commissioni I, XIV e della Commissione parlamentare per le questioni regionali.
VII Commissione (Cultura):
MINARDO: «Istituzione della Soprintendenza speciale per i beni monumentali, architettonici e archeologici della Val di Noto» (704) Parere delle Commissioni I, V, VI (ex articolo 73, comma 1-bis, del Regolamento, per gli aspetti attinenti alla materia tributaria), VIII, XI e della Commissione parlamentare per le questioni regionali.
VIII Commissione (Ambiente):
CASTIELLO ed altri: «Disposizioni per garantire la sicurezza e la corretta gestione degli impianti di depurazione delle acque nella regione Campania» (2109) Parere delle Commissioni I, II (ex articolo 73, comma 1-bis, del Regolamento, per le disposizioni in materia di sanzioni), IV (ex articolo 73, comma 1-bis, del Regolamento), V, XII e della Commissione parlamentare per le questioni regionali.
XII Commissione (Affari sociali):
LOCATELLI ed altri: «Disposizioni concernenti l'etichettatura dei farmaci sperimentati su animali» (1912) Parere delle Commissioni I, X, XIII e XIV.
XIII Commissione (Agricoltura):
MINARDO ed altri: «Disposizioni concernenti la tracciabilità dei prodotti agricoli e agroalimentari per la tutela del consumatore e il contrasto della contraffazione dei prodotti nazionali» (1267) Parere delle Commissioni I, II, V, X, XII, XIV e della Commissione parlamentare per le questioni regionali;
NASTRI: «Istituzione dell'Agenzia fitosanitaria nazionale» (1869) Parere delle Commissioni I, II, V, VII, VIII, XI, XII, XIV e della Commissione parlamentare per le questioni regionali.
Commissioni riunite II (Giustizia) e IX (Trasporti):
PALMIZIO: «Modifiche al codice penale, al codice di procedura penale e al codice della strada, di cui al decreto legislativo 30 aprile 1992, n. 285, in materia di omicidio e di lesioni personali commessi a causa della guida in stato di ebbrezza o di alterazione psico-fisica per uso di sostanze stupefacenti o psicotrope» (2068) Parere delle Commissioni I e XII.
Commissioni riunite III (Affari esteri) e VII (Cultura):
GIANNI FARINA: «Riforma delle istituzioni scolastiche italiane all'estero e interventi per la promozione della lingua e della cultura italiane all'estero» (1907) Parere delle Commissioni I, V e XI.
Annunzio di progetti di atti dell'Unione europea.
La Commissione europea, in data 24 e 25 aprile 2014, ha trasmesso, in attuazione del Protocollo sul ruolo dei Parlamenti allegato al Trattato sull'Unione europea, i seguenti progetti di atti dell'Unione stessa, nonché atti preordinati alla formulazione degli stessi, che sono assegnati, ai sensi dell'articolo 127 del Regolamento, alle sottoindicate Commissioni, con il parere della Commissione XIV (Politiche dell'Unione europea):
Comunicazione della Commissione relativa a sistemi sanitari efficaci, accessibili e resilienti (COM(2014) 215 final), che è assegnata in sede primaria alla XII Commissione (Affari sociali);
Proposta di decisione del Consiglio relativa alla posizione che l'Unione europea deve adottare nell'ambito del Consiglio di associazione istituito dall'accordo di associazione tra l'Unione europea e i suoi Stati membri, da una parte, e l'America centrale, dall'altra, per quanto riguarda l'adozione di decisioni in sede di Consiglio di associazione in merito al regolamento interno del Consiglio di associazione e del comitato di associazione, al regolamento di procedura che disciplina la risoluzione delle controversie di cui al titolo X e al codice di condotta per i membri del collegio e i mediatori, all'elenco dei membri del collegio e all'elenco degli esperti in commercio e sviluppo sostenibile (COM(2014) 237 final) e relativi allegati (COM(2014) 237 final – Annexes 1 – 4), che sono assegnati in sede primaria alla III Commissione (Affari esteri);
Relazione della Commissione al Parlamento europeo e al Consiglio sull'attuazione del regolamento (CE) n. 1921/2006 del Parlamento europeo e del Consiglio, del 18 dicembre 2006, relativo alla trasmissione di dati statistici sugli sbarchi di prodotti della pesca negli Stati membri (COM(2014) 240 final), che è assegnata in sede primaria alla XIII Commissione (Agricoltura);
Relazione della Commissione al Parlamento europeo e al Consiglio sull'applicazione del regolamento (CE) n. 295/2008 del Parlamento europeo e del Consiglio relativo alle statistiche strutturali sulle imprese (COM(2014) 243 final), che è assegnata in sede primaria alla X Commissione (Attività produttive);
Comunicazione della Commissione al Consiglio e al Parlamento europeo – Revisione della politica di controllo delle esportazioni: garantire la sicurezza e la competitività in un mondo che cambia (COM(2014) 244 final), che è assegnata in sede primaria alle Commissioni riunite III (Affari esteri) e X (Attività produttive).
Richieste di parere parlamentare su atti del Governo.
Il Ministro dei beni e delle attività culturali e del turismo, con lettera in data 16 aprile 2014, ha trasmesso, ai sensi dell'articolo 32, comma 2, della legge 28 dicembre 2001, n. 448, la richiesta di parere parlamentare sullo schema di decreto ministeriale concernente il riparto dello stanziamento iscritto nello stato di previsione della spesa del Ministero per l'anno 2014, relativo a contributi ad enti, istituti, associazioni, fondazioni ed altri organismi (95).
Questa richiesta è assegnata, ai sensi del comma 4 dell'articolo 143 del Regolamento, alla VII Commissione (Cultura), che dovrà esprimere il prescritto parere entro il 18 maggio 2014.
Il Ministro per le riforme costituzionali e i rapporti con il Parlamento, con lettera in data 18 aprile 2014, ha trasmesso, ai sensi dell'articolo 17, comma 2, della legge 23 agosto 1988, n. 400, e dell'articolo 1, commi da 217 a 222, della legge 24 dicembre 2012, n. 228, la richiesta di parere parlamentare sullo schema di decreto del Presidente della Repubblica concernente regolamento recante norme per l'attuazione del sistema telematico centrale della nautica da diporto (96).
Questa richiesta è assegnata, ai sensi del comma 4 dell'articolo 143 del Regolamento, alla IX Commissione (Trasporti) che dovrà esprimere il prescritto parere entro il 28 maggio 2014. Essa è altresì assegnata, ai sensi del comma 2 dell'articolo 96-ter del Regolamento, alla V Commissione (Bilancio), che dovrà esprimere i propri rilievi sulle conseguenze di carattere finanziario entro il 13 maggio 2014.
Atti di controllo e di indirizzo.
Gli atti di controllo e di indirizzo presentati sono pubblicati nell’Allegato B al resoconto della seduta odierna.
MOZIONI VALLASCAS ED ALTRI N. 1-00343, LACQUANITI ED ALTRI N. 1-00443 E ALLASIA ED ALTRI N. 1-00444 IN MATERIA DI NOMINE DI COMPETENZA DEL GOVERNO NELLE SOCIETÀ A PARTECIPAZIONE PUBBLICA
Mozioni
La Camera,
premesso che:
con un assegno da 50 mila euro più iva versato dal Governo è stata pagata la consulenza di due società di head hunting (cacciatori di teste), la Spencer & Stuart e la Korn Ferry, incaricate di selezionare i curricula per individuare i nuovi top manager pubblici fuori da logiche di lottizzazione politica, perché bisognava «cambiare verso»;
ma viste le recenti nomine di Eni, Enel, Poste e Finmeccanica non è cambiato nulla; anzi, sono stati nominati amici intimi e finanziatori del Presidente del Consiglio dei ministri Renzi, oltre che manager con un passato politico (l'ex parlamentare europeo Luisa Todini e l'ex deputato Udc Roberto Rao in Poste, l'ex Viceministro Marta Dassù nel consiglio di amministrazione di Finmeccanica);
da numerosi organi di stampa si apprende che il più vicino di tutti al Presidente del Consiglio dei ministri è Alberto Bianchi, nominato nel consiglio di amministrazione dell’Enel. Bianchi è il suo avvocato di fiducia, nonché il presidente della Fondazione Open (dove siedono anche Carrai, la Ministra Maria Elena Boschi e il Sottosegretario Luca Lotti), che per Renzi raccoglie i fondi da donatori privati. Tra quelli che hanno versato soldi a sostegno di Renzi, per le sue campagne alle primarie del Partito democratico, c’è anche Fabrizio Landi, ex amministratore delegato di Esaote, azienda leader del biomedicale con sede a Firenze. Landi nel 2012 ha donato 10 mila euro a Renzi, ora si trova nominato nel consiglio di amministrazione di Finmeccanica. Marco Seracini, uno dei soci fondatori e presidente di un'altra associazione di fund raising (raccolta fondi) per Renzi, Noi Link, ha cessato le sue attività nel 2011, con un ottimo lavoro alle spalle: 750 mila euro raccolti per Renzi, appena nominato nel collegio sindacale dell’Eni;
inoltre, si pone l'attenzione sulla nomina di Emma Marcegaglia, presidente di Eni, che, a parere dei firmatari del presente atto di indirizzo, ha un evidente conflitto d'interesse, visto che l'azienda di famiglia, il gruppo Marcegaglia, è un colosso mondiale dell'acciaio, con 5 milioni di tonnellate di produzione annua, 7 mila dipendenti in 43 stabilimenti su tutto il pianeta, per 4 miliardi di ricavi. Si occupa anche di costruzioni, turismo, real estate (ha appena rilevato la Gabetti) e, per l'appunto, energia. Della quale, naturalmente, è anche un consumatore inesauribile. E, a conferma dei rapporti fitti, inevitabili, tra gruppo e produttori di energia, c’è, nel 2008, un patteggiamento di 11 mesi concesso al fratello di Emma, l'amministratore delegato del gruppo Antonio Marcegaglia, per un'accusa di tangenti proprio a una società dell’Eni, l’Enipower;
è evidente che la logica sulle nomine delle società pubbliche continua ad essere la stessa di sempre, lottizzazione della politica e dei gruppi di potere sostenitori del Governo;
a conferma di ciò il gruppo del MoVimento 5 Stelle discusse un'interpellanza urgente n. 2-00458 del 18 marzo 2014, nella quale si chiedevano al Governo chiarimenti sullo stato di avanzamento della selezione dei manager pubblici e di anticipare al Parlamento le decisioni assunte dal Governo e l'applicazione rigorosa della «direttiva Saccomanni»;
il Sottosegretario per le infrastrutture e i trasporti, che rispose in nome e per conto del Ministro dell'economia e delle finanze e del Governo, non solo, secondo i firmatari del presente atto di indirizzo, fu evasivo su alcune domande, ma si limitò a leggere una risposta preparata dagli uffici competenti ovviamente poco soddisfacente;
si ricorda che i consigli di amministrazione di 14 società controllate dal Ministero dell'economia e delle finanze, più altri 35 consigli di società controllate indirettamente e anche i collegi sindacali di 10 controllate dirette e di 50 controllate indirette sono di imminente rinnovo. In tutto sono 49 consigli di amministrazione e sessanta collegi sindacali. A una media di 5-6 incarichi per ogni organo collegiale si arriva ai 600 incarichi totali da attribuire;
fra le società i cui organi amministrativi e di controllo sono in scadenza, alcune (Agenzia nazionale per l'attrazione degli investimenti e lo sviluppo d'impresa; Arcus; Istituto Luce-Cinecittà; Italia lavoro; Sogin; Sose e Studiare sviluppo) appaiono ai firmatari del presente atto di indirizzo perfettamente inutili e improduttive; le loro funzioni, in un processo di logica razionalizzazione delle competenze, ottimizzazione dei processi decisionali e contenimento delle spese, potrebbero essere attribuite a esistenti strutture ministeriali;
il Ministro dell'economia e delle finanze ha emanato una direttiva, in base alla mozione n. 1-00060 approvata al Senato della Repubblica il 19 giugno 2013;
la direttiva dispone che per la valutazione delle candidature, si deve tener conto per i candidati, tra gli altri, dei seguenti elementi:
a) non devono essere membri del Parlamento, del Parlamento europeo, del consiglio di una regione o di enti locali con popolazione superiore a 15.000 abitanti;
b) devono possedere comprovata professionalità ed esperienza in ambito giuridico, finanziario o industriale;
c) non devono avere conflitti di interesse rispetto all'incarico da assegnare;
inoltre, si stabilisce come causa di ineleggibilità o decadenza dall'incarico l'aver subito una condanna, anche non definitiva, per delitti contro la pubblica amministrazione o per altri reati in materia bancaria, finanziaria, assicurativa. Le società partecipate dovranno modificare gli statuti, tenendo conto delle disposizioni contenute nella direttiva. Le remunerazioni dei nominati devono essere stabilite sulla base delle performance aziendali ed ispirate a criteri di moderazione dei compensi;
ma tale direttiva non contempla un limite ai mandati e all'età degli amministratori e non impedisce alla folta schiera dei politici non rieletti di aspirare a un posto di primo piano. Inoltre, la parte della direttiva dove si parla dell'ineleggibilità legata a fatti giudiziari appare molto elastica e non disciplina chiaramente eventuali conflitti d'interesse;
si prevede che il Ministro, prima di procedere alle nomine, acquisisca un parere positivo da parte di un comitato di garanzia composto da Cesare Mirabelli, presidente emerito della Corte costituzionale, Vincenzo Desario, ex direttore generale della Banca d'Italia, e Maria Teresa Salvemini, consigliere del Cnel. Tale comitato costa 50.000 euro l'anno;
ma le recenti nomine sono, secondo i firmatari del presente atto di indirizzo, la dimostrazione palese che il comitato di garanzia, la «direttiva Saccomanni» e le due società di head hunting (cacciatori di teste) non sono state efficaci e non hanno garantito i criteri di trasparenza, pubblicità, professionalità, onorabilità ed indipendenza che nomine di società partecipate dello Stato devono avere;
questo è possibile solo attraverso un pieno coinvolgimento del Parlamento e la fissazione di tutti i criteri di nomina attraverso una norma di rango primario scevra da ogni interpretazione e deroghe capziose;
come già espresso nella mozione 1-00301, tali grandi aziende costituiscono il tessuto connettivo dell'economia del Paese e sono tutte strategiche per la loro funzione attuale e per quella che potranno svolgere in futuro nella ristrutturazione ecologica, civile e tecnologica del sistema economico italiano. Esse sono state costruite con il lavoro e le tasse di 4 o 5 generazioni di italiani lungo il corso di oltre un secolo: i proprietari delle quote residue in mano allo Stato sono, dunque, i cittadini italiani che non possono essere espropriati della possibilità di decidere sul loro assetto attuale e futuro;
le società pubbliche sono strategicamente rilevanti per il posizionamento dell'industria nazionale, in un quadro di definizione degli equilibri di mercato interno e internazionale; il bilancio dello Stato è positivamente ristorato dagli utili derivanti dalle profittevoli attività dei gruppi di imprese facenti capo alle sopra citate attività;
bisogna porre fine ad una selezione dei componenti dei consigli d'amministrazione e dei collegi basata su umilianti logiche spartitorie e di appartenenza,
impegna il Governo:
a fornire immediati chiarimenti sullo stato di avanzamento della selezione dei manager pubblici e ad anticipare al Parlamento le decisioni assunte dal Governo in materia di nomine pubbliche;
a sospendere le nomine in quelle società definite in premessa inutili e improduttive e le cui funzioni, in un processo di logica razionalizzazione delle competenze, ottimizzazione dei processi decisionali e contenimento delle spese, potrebbero essere attribuite a esistenti strutture ministeriali;
ad assumere urgentemente un'iniziativa normativa di rango primario volta a prevedere che le proposte governative di nomina dei membri dei consigli di amministrazione e dei collegi sindacali delle società a partecipazione pubblica totale o di controllo siano effettuate secondo i seguenti criteri e modalità, in aggiunta a quelli previsti dalla direttiva del Ministero dell'economia e delle finanze del 24 giugno 2013:
a) che siano sottoposte al previo parere delle competenti commissioni parlamentari, al fine di verificare la professionalità, l'onorabilità, l'indipendenza e gli eventuali conflitti di interesse;
b) che sia comunque prevista l'incompatibilità per coloro che:
1) abbiano un procedimento giudiziario in corso;
2) abbiano già ricoperto l'incarico per due mandati consecutivi;
3) abbiano superato i limiti di età di 66 anni;
4) pur essendo stati candidati, non siano stati eletti nel Parlamento, nel Parlamento europeo, nel consiglio di una regione o di enti locali con popolazione superiore a 15 mila abitanti o abbiano ricoperto incarichi governativi negli ultimi cinque anni.
(1-00343)
(Nuova formulazione) «Vallascas, Prodani, Da Villa, Crippa, Petraroli, Fantinati, Rizzetto, Rostellato, Mucci, Della Valle».
La Camera,
premesso che:
nell'ambito delle recenti politiche tese a garantire la trasparenza e la moralizzazione della vita pubblica possono annoverarsi le determinazioni assunte dal Parlamento e dal Governo, già dai primi mesi della XVII Legislatura, relativamente ai requisiti ed alle modalità di nomina dei componenti degli organi di amministrazione delle società controllate dal Ministero dell'economia e delle finanze, un gruppo eterogeneo composto da decine di imprese, tra le quali spiccano, in particolare, Eni, Cassa depositi e prestiti, Enel, Finmeccanica, Ferrovie dello Stato, Poste Italiane, ANAS, SOGEI e altre;
tali determinazioni avrebbero dovuto rappresentare una risposta allo scandalo che ha coinvolto negli anni scorsi i vertici di Finmeccanica, e più in generale, al malcostume politico che molto spesso ha caratterizzato le nomine delle imprese pubbliche nel nostro Paese;
sotto tale profilo, appare utile segnalare che lo scorso anno, Parlamento e Governo, hanno seguito la strada quasi mai utilizzata di concordare reciprocamente talune prescrizioni;
non a caso, in vista dell'approssimarsi delle scadenze di importanti incarichi presso imprese partecipate dallo Stato, il Senato ha esaminato, discusso ed approvato alcune mozioni sulle nomine dei consigli di amministrazione delle società pubbliche, presentate da diverse forze politiche, che sono poi confluite in una mozione unitaria;
il 19 giugno 2013, infatti, l'Assemblea del Senato ha approvato la mozione 1-00060 (testo 4) a prima firma Tomaselli che impegnava il Governo a prevedere l'adozione da parte del Ministro dell'economia e delle finanze di specifiche direttive tese a individuare criteri e modalità per la nomina e la decadenza dei componenti gli organi di amministrazione delle società controllate, direttamente o indirettamente, con l'introduzione di una specifica causa di ineleggibilità in caso di rinvio a giudizio o condanna per gravi fattispecie di reato e l'attivazione di una valutazione dei requisiti professionali basata su esperienza, autorevolezza, assenza di conflitti di interesse. La mozione impegnava, inoltre, il Governo a riferire annualmente alle competenti Commissioni parlamentari circa l'applicazione dei criteri e procedure adottati; a promuovere nelle assemblee societarie l'adozione di criteri trasparenti ed equilibrati nella remunerazione dei vertici manageriali; e infine a promuovere l'adozione di analoghe procedure da parte delle altre pubbliche amministrazioni. Tutti i gruppi parlamentari hanno votato a favore della mozione, ad eccezione di Scelta Civica per l'Italia che si è astenuta in conseguenza del mancato accoglimento di due emendamenti che fissavano un limite di tre mandati e impedivano agli ex parlamentari di transitare nei consigli di amministrazione delle società pubbliche;
contestualmente il Ministero dell'economia e delle finanze ha elaborato una direttiva ministeriale volta ad introdurre nuove regole in materia di nomine di componenti dei consigli di amministrazione delle società pubbliche;
in questo senso deve, quindi, leggersi la singolare contemporaneità della approvazione della mozione Tomaselli ed altri 1-00060 (testo 4), avvenuta il 19 giugno 2013, con la emanazione della direttiva ministeriale 14656 effettuata poco dopo, e segnatamente, il 24 giugno 2013;
tale sincronismo avrebbe potuto rappresentare per il Governo, all'epoca presieduto dal Presidente del Consiglio pro tempore onorevole Enrico Letta, un doppio vantaggio politico, ovverosia, quello di alleggerirsi delle forti pressioni opposte che una materia così delicata richiama, ma anche e soprattutto, quello di fortificare la propria direttiva, presentandola non come il frutto di una propria scelta, ma come il puntuale svolgimento di un indirizzo impartito da una ampia, sebbene eterogenea, maggioranza parlamentare;
sotto tale profilo, si deve tuttavia rilevare che, sebbene la mozione citata rechi evidentemente la volontà di imprimere una svolta decisa in termini di trasparenza, di professionalità, di moralizzazione in un ambito molto difficile, quale è appunto quello delle nomine dei vertici delle imprese pubbliche, nella versione conclusiva non compaiono tuttavia alcuni passaggi importanti il che ha, ad avviso dei firmatari del presente atto di indirizzo, inevitabilmente condizionato la stesura della successiva direttiva ministeriale 14656 con riferimento, in particolare, alla limitazione del numero dei mandati, essenziale per impedire la formazione di concrezioni di potere che alimentano processi degenerativi e la fissazione di una età massima dei candidati, utile barriera per contrastare la gerontocrazia e i non sempre apprezzabili passaggi da cariche di vertice delle amministrazioni pubbliche e delle magistrature a cariche di vertice di grandi imprese pubbliche, impiegate per lo più come premio di fine carriera per pensionati pubblici di lusso;
solo recentissimamente, infatti, in data 8 aprile 2014, poco prima delle nomine annunciate dal Governo Renzi il 14 aprile 2014, è stata votata a larga maggioranza, su proposta del presidente della Commissione industria del Senato, Massimo Mucchetti, una risoluzione che impone il limite dei tre mandati per i vertici delle partecipate dello Stato, sia per il presidente che per l'amministratore delegato (7-00096);
a ciò si aggiunge che la citata direttiva ministeriale 14656 del 24 giugno 2013 immediatamente successiva all'approvazione della mozione del Senato ha recepito, ad avviso dei firmatari del presente atto di indirizzo, in modo del tutto insoddisfacente talune indicazioni formulate dal Parlamento;
detta direttiva, infatti, dopo aver rammentato che i requisiti per accedere e mantenere le cariche societarie già previsti dalla legge, dagli statuti sociali e dalle direttive ministeriali, continuano ad essere vigenti, introduce una serie di ipotesi aggiuntive, riguardanti l'onorabilità, l'insussistenza di condizioni ostative e la professionalità;
per quanto attiene ai nuovi requisiti di onorabilità, si evidenzia come essi siano specificati nell'allegato alla direttiva e (a differenza degli altri) non siano requisiti di diretta applicazione, ma divengano obbligatori soltanto in quanto essi siano inseriti (come la direttiva richiede) negli statuti societari;
per quanto riguarda l'insussistenza delle condizioni ostative richieste per ricoprire le cariche delle imprese controllate dallo Stato, la direttiva ne indica due: l'assenza di conflitti di interesse (viene specificato «anche in riferimento ad eventuali cariche in società concorrenti») e il fatto di non essere membri di assemblee politiche o amministrative elettive;
sotto tale profilo si rileva come le prescrizioni concernenti i conflitti di interesse contenuti nella direttiva riflettano, con tutta evidenza, una inadeguata considerazione della complessità e delicatezza delle questioni più generalmente discusse e ridiscusse da anni nel nostro Paese;
quanto ai conflitti di interesse, in particolare, è del tutto ovvio che essi, se sussistono, o possono sussistere, debbano impedire l'accesso alle cariche o debbano comportare la decadenza da esse. La prescrizione della direttiva risulta dunque superflua, poiché non è integrata dalla essenziale tipizzazione delle situazioni di conflitto di interessi nuove (cioè non già contemplate dalle leggi o dagli statuti) in quell'area grigia degli interessi «di fatto», oltre che «di diritto», in cui notoriamente si insinuano i maggiori rischi di opacità;
sotto tale profilo, in punto di diritto, si segnala, da ultimo, come il gruppo SEL abbia recentissimamente presentato un'interrogazione parlamentare a firma Marcon, Airaudo, Duranti, Ferrara, Piras per chiedere al Governo di revocare la nomina dell'ex Viceministro degli affari esteri Marta Dassù nel consiglio di amministrazione di Finmeccamca, perché tale nomina, secondo gli interroganti, viola palesemente l'articolo 2 della legge n. 215 del 2004 sul conflitto di interessi;
infatti, fino al 22 febbraio 2014, la professoressa Dassù è stata Viceministro degli affari esteri, con le deleghe, tra le altre materie, alla politica estera e di sicurezza comune e alla politica europea di sicurezza e difesa, mentre la legge n. 215 del 2004, all'articolo 2, recita testualmente, a proposito delle incompatibilità tra incarichi di governo e in enti di diritto pubblico o anche economici che: «l'incompatibilità perdura per 12 mesi dal termine della carica di governo nei confronti di enti di diritto pubblico, anche economici, nonché di società aventi fini di lucro che operino prevalentemente in settori connessi con la carica ricoperta». È quindi evidente, sotto tale profilo, come le deleghe assunte dalla professoressa Dassù nel precedente Governo si intreccino con la missione e le attività del gruppo Finmeccanica e che sia configurabile in tal senso una situazione di conflitto di interesse;
nondimeno, anche la recente nomina di Emma Marcegaglia a presidente di Eni (che rientra insieme a Terna e SNAM tra le principali società partecipate dalla Cassa depositi e prestiti) appare risentire di una evidente situazione di conflitto di interesse, considerato che il gruppo industriale di proprietà della sua famiglia rappresenta il leader mondiale nella trasformazione dell'acciaio con rilevanti coinvolgimenti sia nel settore dell'energia e conseguentemente in quello del gas;
stando a quanto previsto dalla direttiva ministeriale, poi, si segnala come i requisiti di eleggibilità alle cariche richiesti dalla direttiva includano il possesso di una «comprovata professionalità ed esperienza in ambito giuridico, finanziario o industriale». Tale generica richiesta viene più specificamente articolata per le cariche di amministratore delegato: si precisa infatti la necessità di una congrua esperienza pregressa di analogo livello di responsabilità, si individuano i possibili contesti nei quali tale esperienza debba essere stata svolta, si domandano doti di autorevolezza verificabili in ragione della reputazione, dei risultati conseguiti, della «riconoscibilità» nei mercati di riferimento;
tale misura di valutazione, pur tuttavia, non è in alcun modo dettagliata in rapporto alle caratteristiche proprie e specifiche di ciascuna delle imprese controllate dal Ministero dell'economia e delle finanze che, come noto, si occupano di molteplici attività di carattere economico e industriale. Inoltre, del tutto vaghe appaiono pure le indicazioni della direttiva per i candidati alla carica di presidente, che lasciano un varco aperto all'esercizio di una amplissima discrezionalità svincolata da esperienze specifiche svolte in contesti significativi e con risultati acclarati;
le conseguenze, purtroppo, sono sotto gli occhi di tutti: basti pensare alla recente nomina a presidente di Enel di Patrizia Grieco, persona di comprovata esperienza in campi quali l'informatica e le telecomunicazioni, ma non certo in campi attinenti all'ambito energetico; oppure a quella di Patrizia Todini, nominata presidente di Poste Italiane, persona proveniente da una famiglia di costruttori con cui, attualmente, continua a svolgere un tipo di attività molto lontana dal servizio pubblico universale delle comunicazioni; o anche Mauro Moretti, recentemente nominato amministratore delegato di Finmeccanica e che appena un anno fa era stato confermato per un nuovo triennio alla guida delle Ferrovie dello Stato, l'azienda in cui ha lavorato tutta la carriera e che adesso dovrà occuparsi di un'azienda strategica, come Finmeccanica, che si sta concentrando sempre di più sul ramo armamenti ed ha avviato la dismissione di alcuni pezzi importanti del civile, tra cui i trasporti, a meno che non vi sia un ravvedimento da parte del Governo in tal senso come più volte auspicato da SEL in numerosissime mozioni parlamentari;
per quanto attiene, poi, alle procedure selettive, la direttiva ministeriale prevede che la selezione e la individuazione dei candidati delle cariche nelle società controllate direttamente dal Ministero dell'economia e delle finanze debba avvenire attraverso una procedura articolata in più passaggi e sommariamente descritta, che coinvolge non solo il dipartimento ed il Ministro, ma anche società esterne specializzate nella ricerca e nella selezione di top manager ed un comitato di garanzia, costituito con carattere di stabilità e composto da personalità indipendenti di comprovata competenza in materia giuridica ed economica;
la stessa direttiva prevede, tuttavia, che, nelle more dell'allestimento di tale nuovo regime, per il quale non è comunque assegnato un termine, si dia corso ad una «non meglio specificata procedura semplificata», che fa comunque salva la funzione di verifica affidata al Comitato di garanzia attualmente costituito da Cesare Mirabelli, presidente emerito della Consulta, Vincenzo Desario, ex direttore generale della Banca d'Italia e Maria Teresa Salvemini, consigliere del CNEL;
in fine, va segnalata una grave dimenticanza della direttiva, che omette di precisare, contrariamente a quanto richiesto dalla mozione parlamentare approvata dal Senato nel giugno 2013, i termini e modi in cui il Ministero debba informare le Commissioni parlamentari circa l'attuazione delle nuove procedure di nomina;
talune delle recenti nomine comunicate dal Governo, solo il 14 aprile 2014, in relazione alla composizione dei consigli di amministrazione di importantissime società a partecipazione pubblica suscitano particolare perplessità per tutti i motivi anzidetti;
come si è detto l'8 aprile 2014, circa una settimana prima delle nomine comunicate dal Governo Renzi, il Senato ha approvato a larga maggioranza in Commissione industria la risoluzione (7-00096) che impegna il Governo a:
a) impostare su base meritocratica la formazione delle liste per i consigli di amministrazione delle società nelle quali il Ministero dell'economia e delle finanze esercita, direttamente o indirettamente, il controllo di diritto o di fatto, avendo particolare cura di evitare situazioni di conflitto di interesse;
b) subordinare l'eventuale riconferma dei presidenti e degli amministratori delegati uscenti alla valutazione del ruolo di ciascuno e dei risultati della società sul piano industriale, su quello della remunerazione del capitale investito dall'azionista, nonché sui risultati dei bilanci di sostenibilità, e in ogni caso avendo come limite massimo quello di tre mandati;
c) osservare, ai fini della corporate governance, le positive indicazioni adottate dalle società Enel ed Eni sull'indipendenza dei presidenti contenute negli orientamenti del consiglio di amministrazione agli azionisti sulla dimensione e composizione del nuovo consiglio di amministrazione;
d) trasmettere al Parlamento una relazione che illustri le ragioni e le finalità delle scelte fatte nella formazione delle liste e nella designazione di presidenti e amministratori delegati, nonché degli obiettivi generali loro affidati;
e) trasmettere inoltre al Parlamento, con cadenza annuale, una relazione sull'andamento delle società, in relazione al mandato ricevuto;
f) procedere ad una riduzione della retribuzione lorda totale (comprensiva delle parti fisse e variabili, di eventuali stock option e stock grant nonché dei trattamenti di fine rapporto) di chi sia designato a ricoprire le cariche di presidente ed amministratore delegato, sulla base di un forte principio di progressività e, per il futuro, a legare l'eventuale miglioramento dei compensi dei capiazienda al proporzionale miglioramento sostenibile dei salari;
g) esigere da chi sia designato amministratore delle società a operare affinché i consigli di amministrazione di queste stesse società rendano note in una relazione allegata al bilancio annuale, in base ai criteri individuati con provvedimento del Ministro dell'economia e delle finanze, le spese per pubblicità, sponsorizzazioni e liberalità indicandone i beneficiari;
h) valorizzare, senza ulteriori oneri a carico del bilancio dello Stato, la direzione del Ministero dell'economia e delle finanze preposta al controllo delle partecipazioni azionarie dello Stato in relazione ai mandati assegnati e nel rispetto delle norme sulle incompatibilità di cui al decreto legislativo n. 39 del 2013, anche istituendo, all'interno della direzione, delle specifiche unità di valutazione dei risultati delle aziende;
i) rispettare nella definizione delle liste i requisiti di onorabilità, oltre a quelli di professionalità indicati nella mozione sulle nomine, approvata il 19 giugno 2013 dal Senato,
impegna il Governo
a porre in essere ogni atto di competenza finalizzato a revocare le recenti nomine rispetto alle quali, ad avviso dei firmatari del presente atto di indirizzo, si appalesano i più evidenti conflitti di interesse, con particolare riferimento a quelle dell'ex Viceministro degli affari esteri Marta Dassù nell'ambito del consiglio di amministrazione di Finmeccanica, nonché quella di Emma Marcegaglia a presidente di ENI;
ad informare immediatamente e nel modo più possibile dettagliato il Parlamento circa le procedure seguite ai sensi della citata direttiva ministeriale 14656, con riferimento alle nomine dei consigli di amministrazione comunicate dal Governo il 14 aprile 2014 e le modalità attraverso le quali sia stata data attuazione in tal senso alla recente risoluzione approvata dal Senato l'8 aprile 2014;
a riferire circa i requisiti e le modalità valutative in forza delle quali il Comitato di garanzia sia stato concretamente messo in condizione di operare le proprie verifiche, al fine di assicurare che lo stesso Comitato possa svolgere un ruolo realmente significativo a fronte di una situazione di fatto che potrebbe rischiare di dare una apparenza di obbiettività a scelte che potrebbero rivelarsi solo di carattere eminentemente politico;
ad informare tempestivamente le Commissioni parlamentari sullo stato di avanzamento della selezione dei manager pubblici, assicurando in tal senso il massimo coinvolgimento preventivo dei parlamentari;
ad adottare le opportune iniziative di competenza finalizzate ad integrare le prescrizioni previste dalla citata direttiva ministeriale 14656 alla luce delle omissioni e delle criticità rilevate dal presente atto di indirizzo, con particolare riferimento ai requisiti ed al procedimento di selezione per la nomina dei componenti dei consigli di amministrazione delle società pubbliche o, in alternativa, ad adottare apposite iniziative normative di rango primario tese ad uniformare in modo organico un'efficace disciplina di riferimento.
(1-00443) «Lacquaniti, Matarrelli, Ferrara, Migliore, Di Salvo, Marcon, Airaudo, Duranti, Piras, Pannarale».
(Mozione non iscritta all'ordine del giorno ma vertente su materia analoga)
La Camera,
premesso che:
il sistema economico del Paese registra la presenza di società, partecipate direttamente od indirettamente da soggetti pubblici, frutto di un'evoluzione storica, peraltro assimilabile a quella della maggior parte degli altri Paesi europei, improntata alla gestione di alcuni servizi e al sostegno ad alcuni settori produttivi considerati importanti e strategici non solo a fini economici ma anche per garantire alcuni servizi essenziali a tutti i cittadini;
il quadro normativo riguardante le società a partecipazione pubblica è complesso a causa dei diversi profili coinvolti: alla normativa societaria si sovrappongono gli effetti indiretti delle norme sul Patto di stabilità e sulla spending review, che condizionano gli enti pubblici che partecipano dei capitali delle società; inoltre sono presenti alcune normative di settore, principalmente di derivazione europea, riguardanti la concorrenza e la liberalizzazione di taluni servizi;
negli ultimi anni tuttavia le società, in particolare quelle partecipate da enti pubblici, hanno adottato iniziative volte a garantire la trasparenza non solo delle proprie scelte strategiche ma anche della scelta e della adeguatezza del proprio management, superando generalmente quanto comunque previsto dalla legge e con lo scopo, oltre che di garantire trasparenza, di rendersi più forti e credibili rispetto ai mercati nei quali operano;
i poteri di nomina da parte dell'azionista pubblico degli amministratori delle società partecipate sono disciplinati, a livello generale, dal codice civile, nonché da una serie di ulteriori disposizioni. In primo luogo, la disciplina generale (articolo 2449 del codice civile) prevede che, se lo Stato o gli enti pubblici hanno partecipazioni in una società per azioni che non fa ricorso al mercato del capitale di rischio, lo statuto può attribuire loro la facoltà di nominare amministratori, sindaci o componenti del consiglio di sorveglianza, in numero proporzionale alla partecipazione al capitale sociale;
gli amministratori e i sindaci o i componenti del consiglio di sorveglianza nominati dallo Stato e dagli enti pubblici possono essere revocati solo dagli enti che li hanno nominati ed hanno i diritti e gli obblighi dei membri nominati dall'assemblea. Gli amministratori non possono essere nominati per un periodo superiore a tre esercizi e scadono alla data dell'assemblea convocata per l'approvazione del bilancio relativo all'ultimo esercizio della loro carica;
i sindaci, ovvero i componenti del consiglio di sorveglianza, restano in carica per tre esercizi e scadono alla data dell'assemblea convocata per l'approvazione del bilancio relativo al terzo esercizio della loro carica. Per le società che fanno ricorso al mercato azionario è prevista la possibilità di riservare allo Stato o agli enti partecipanti azioni fornite di diritti patrimoniali o anche di diritti amministrativi, ma non il voto nell'assemblea generale degli azionisti;
alcuni importanti accorgimenti sono stati adottati dal legislatore per garantire che le società pubbliche siano orientate a criteri di efficienza, penalizzando gli amministratori che non agiscono con competenza e capacità. Ne è esempio la previsione in base alla quale non può essere nominato amministratore di ente, istituzione, azienda pubblica, società a totale o parziale capitale pubblico chi, avendo ricoperto nei cinque anni precedenti incarichi analoghi, ha chiuso in perdita tre esercizi consecutivi (articolo 1, comma 734, della legge n. 296 del 2006);
i principali dati relativi alle società a partecipazione pubblica sono disponibili e fruibili in diverse forme, compreso il canale internet. L'elenco delle società per azioni partecipate da amministrazioni statali è contenuto nel rendiconto generale dello Stato, nel conto del patrimonio (appendice 4). Il Ministero dell'economia e delle finanze è il principale azionista statale. Le informazioni disponibili sul sito del Ministero riferiscono che a novembre 2012 il dicastero deteneva 31 partecipazioni dirette;
la legge 12 luglio 2011, n. 120, sulla parità di accesso agli organi delle società quotate, volta a superare il problema della scarsa presenza di donne negli organi di vertice delle società commerciali e, in particolare, nei consigli di amministrazione delle società quotate in borsa, dispone che, per le società a controllo pubblico, i principi applicabili rimangono quelli di legge, mentre la disciplina di dettaglio è affidata ad un apposito regolamento, con la finalità di garantire una disciplina uniforme per tutte le società interessate. Tale regolamentazione è contenuta nel regolamento di cui al decreto del Presidente della Repubblica 30 novembre 2012, n. 251. Ad esso è affidata la disciplina della vigilanza sull'applicazione delle disposizioni introdotte, nonché delle forme e dei termini dei provvedimenti da adottare e delle modalità di sostituzione dei componenti decaduti;
in particolare, tale regolamento impone, come avviene per le società private, agli statuti delle società pubbliche non quotate di prevedere modalità di nomina degli organi di amministrazione e di controllo, se a composizione collegiale, tali da garantire che il genere meno rappresentato ottenga almeno un terzo dei componenti di ciascun organo. In tali ipotesi gli statuti disciplinano ugualmente la formazione delle liste in applicazione del criterio di riparto tra generi, prevedendo modalità di elezione e di estrazione dei singoli componenti idonee a garantire il rispetto delle previsioni di legge;
ai sensi dell'articolo 18, comma 2, del decreto-legge 25 giugno 2008, n. 112, convertito, con modificazioni, dalla legge n. 133 del 2008, le società a partecipazione pubblica totale o di controllo adottano, per il reclutamento del personale e per il conferimento degli incarichi, criteri e modalità rispettosi dei principi, anche di derivazione comunitaria, di trasparenza, pubblicità e imparzialità;
il Senato, il 19 giugno 2013, ha approvato una mozione sui criteri di nomina degli amministratori delle società quotate e non quotate controllate direttamente o indirettamente dallo Stato, le cui indicazioni sono successivamente state fatte proprie dal Governo con la direttiva del Ministero dell'economia e delle finanze del 24 giugno 2013,
impegna il Governo
ad assumere iniziative per disciplinare e rendere pubblici, laddove non abbia già provveduto in tal senso, anche nel rispetto delle disposizioni contenute nel regolamento di cui al decreto del Presidente della Repubblica 30 novembre 2012, n. 251, i requisiti richiesti per la candidatura alla carica di componente dei consigli di amministrazione delle società a partecipazione pubblica totale o di controllo;
a subordinare l'eventuale riconferma dei presidenti e degli amministratori delegati uscenti alla valutazione dei risultati aziendali conseguiti ed in ogni caso avendo come limite massimo quello di tre mandati;
a procedere ad una generale riduzione della retribuzione lorda totale di chi sia designato a ricoprire le cariche di presidente ed amministratore delegato, subordinandola al contempo ai risultati gestionali conseguiti;
ad adottare ogni opportuna iniziativa, anche di carattere normativo, volta a prevedere, ove non già disposto, la sottoposizione delle proposte governative di nomina dei membri dei consigli di amministrazione delle società a partecipazione pubblica totale o di controllo al parere delle competenti Commissioni parlamentari.
(1-00444) «Allasia, Guidesi, Caparini, Fedriga, Attaguile, Borghesi, Bossi, Matteo Bragantini, Buonanno, Busin, Caon, Giancarlo Giorgetti, Grimoldi, Invernizzi, Marcolin, Molteni, Gianluca Pini, Prataviera, Rondini».
(Mozione non iscritta all'ordine del giorno ma vertente su materia analoga)
DISEGNO DI LEGGE: CONVERSIONE IN LEGGE DEL DECRETO-LEGGE 20 MARZO 2014, N. 36, RECANTE DISPOSIZIONI URGENTI IN MATERIA DI DISCIPLINA DEGLI STUPEFACENTI E SOSTANZE PSICOTROPE, PREVENZIONE, CURA E RIABILITAZIONE DEI RELATIVI STATI DI TOSSICODIPENDENZA, DI CUI AL DECRETO DEL PRESIDENTE DELLA REPUBBLICA 9 OTTOBRE 1990, N. 309, NONCHÉ DI IMPIEGO DI MEDICINALI MENO ONEROSI DA PARTE DEL SERVIZIO SANITARIO NAZIONALE (A.C. 2215-A/R)
A.C. 2215-A/R – Proposte emendative
PROPOSTE EMENDATIVE RIFERITE AGLI ARTICOLI DEL DECRETO-LEGGE PRESENTATE DALLE COMMISSIONI AL TESTO A E ANNUNCIATE IN AULA
Sostituire la Tabella I con la seguente:

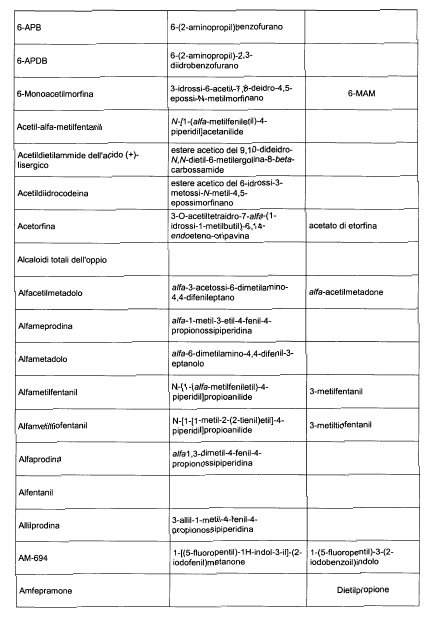
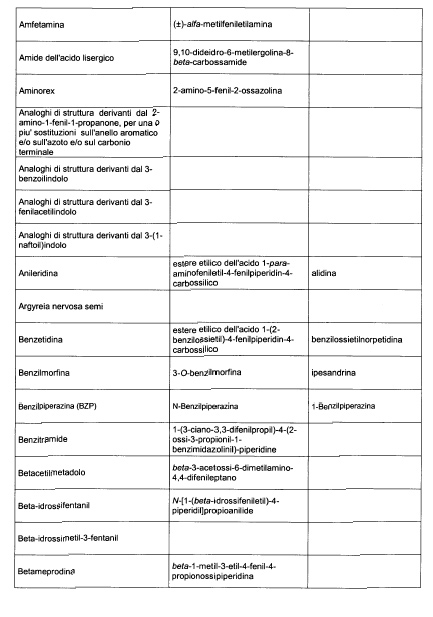
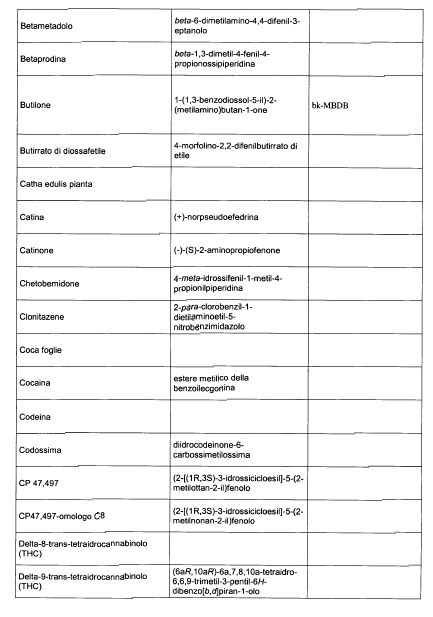
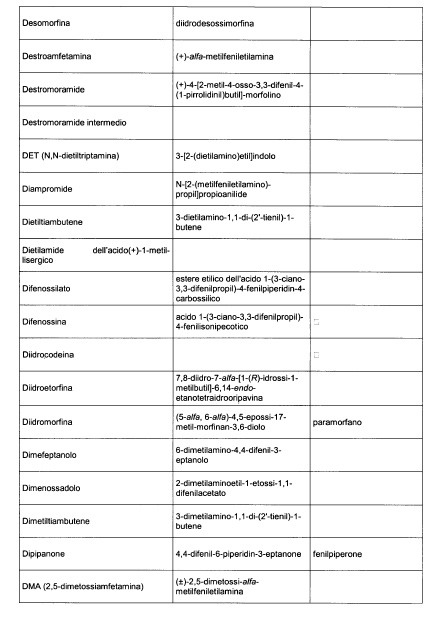
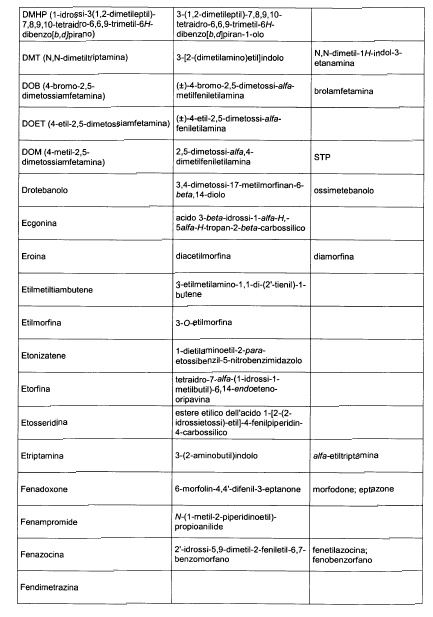
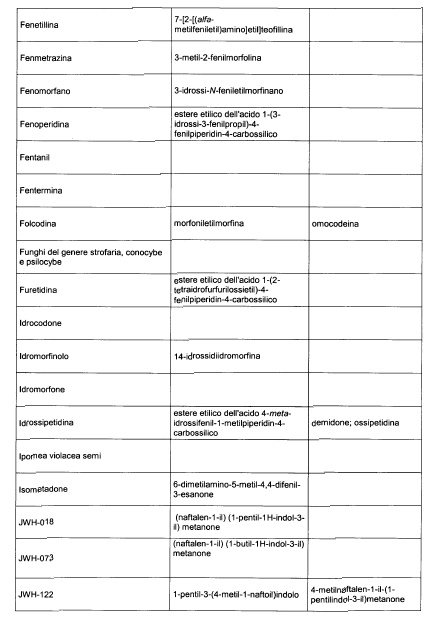
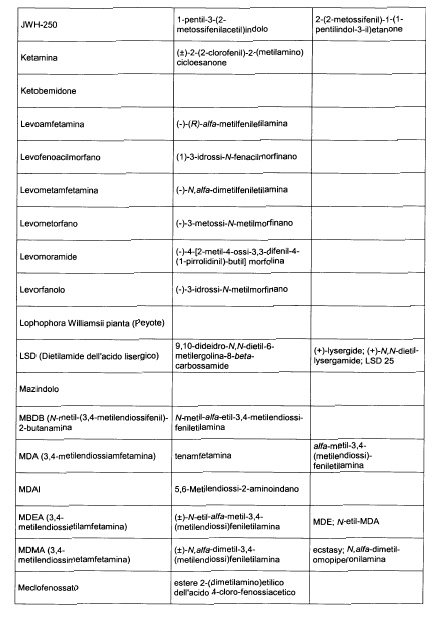
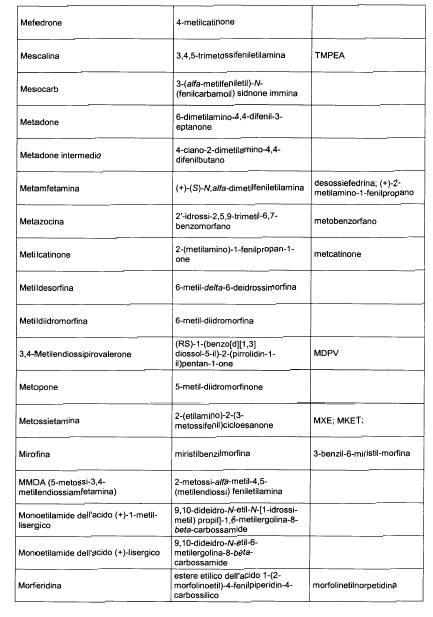
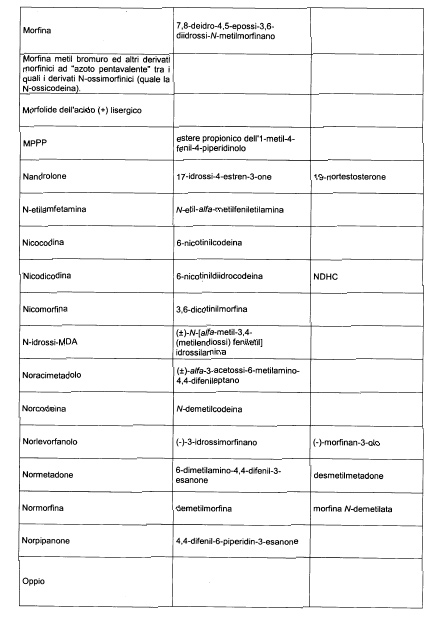
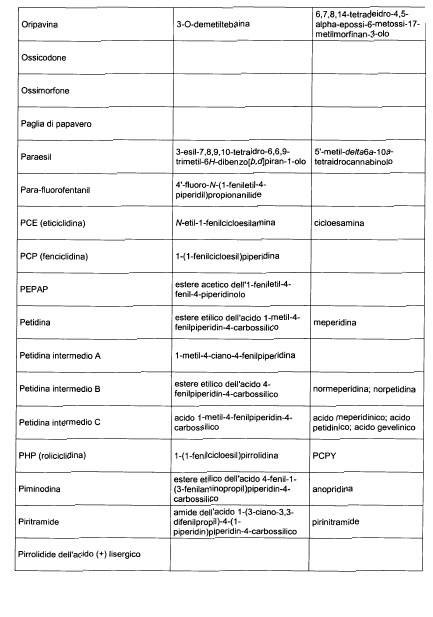
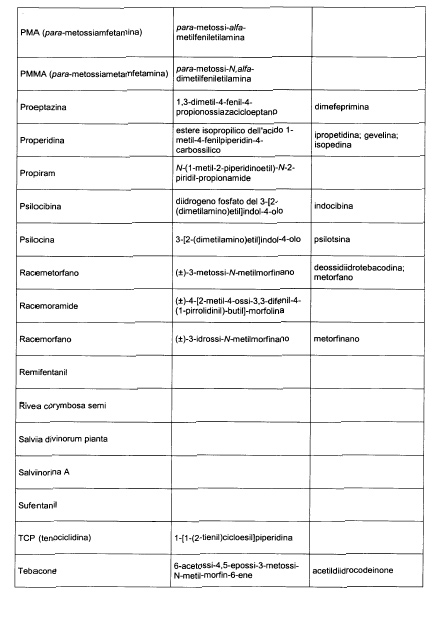

1. 700. Le Commissioni.
Alla tabella IV, dopo la voce: Alprazolam aggiungere la seguente: Amineptina, e dopo la voce: Nordazepam aggiungere la seguente: Ossazepam.
1. 701. Le Commissioni.
A.C. 2215-A/R – Parere della I Commissione
PARERE DELLA I COMMISSIONE SULLE PROPOSTE EMENDATIVE PRESENTATE
PARERE CONTRARIO
sull'emendamento Nicchi 1.109
e
NULLA OSTA
sui restanti emendamenti contenuti nel fascicolo n. 1 e sugli emendamenti 1.700 e 1.701 delle Commissioni.
A.C. 2215-A/R – Parere della V Commissione
PARERE DELLA V COMMISSIONE SUL TESTO DEL PROVVEDIMENTO E SULLE PROPOSTE EMENDATIVE PRESENTATE
Sul testo del provvedimento in oggetto
PARERE FAVOREVOLE
sugli emendamenti trasmessi dall'Assemblea
PARERE CONTRARIO
sugli emendamenti 1.30, 1.42, 1.47, 1.101, 1.107, 1.108, 1.581, 3.108, 3.109, 3.113, 3.114, 3.115, 3.116, e sull'articolo aggiuntivo 3.02, in quanto suscettibili di determinare nuovi o maggiori oneri per la finanza pubblica privi di idonea quantificazione e copertura;
NULLA OSTA
sugli emendamenti 1.700 e 1.701, nonché sulle restanti proposte emendative.
A.C. 2215-A/R – Articolo unico
ARTICOLO UNICO DEL DISEGNO DI LEGGE DI CONVERSIONE NEL TESTO DELLE COMMISSIONI
ART. 1.
1. Il decreto-legge 20 marzo 2014, n. 36, recante disposizioni urgenti in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, nonché di impiego di medicinali meno onerosi da parte del Servizio sanitario nazionale, è convertito in legge con le modificazioni riportate in allegato alla presente legge.
2. La presente legge entra in vigore il giorno successivo a quello della sua pubblicazione nella Gazzetta Ufficiale.
ARTICOLI DEL DECRETO-LEGGE NEL TESTO DEL GOVERNO
Capo I
DISPOSIZIONI IN MATERIA DI STUPEFACENTI E SOSTANZE PSICOTROPE, PREVENZIONE, CURA E RIABILITAZIONE DEI RELATIVI STATI DI TOSSICODIPENDENZA
ART. 1.
(Modificazioni al testo unico di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309).
1. All'articolo 2 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, alla lettera e), il numero 2) è sostituito dal seguente: «2) il completamento e l'aggiornamento delle tabelle di cui all'articolo 13, sentiti il Consiglio superiore di sanità e la Presidenza del Consiglio dei ministri-Dipartimento nazionale per le politiche antidroga;».
2. All'articolo 13 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
«1. Le sostanze stupefacenti o psicotrope sottoposte alla vigilanza ed al controllo del Ministero della salute e i medicinali a base di tali sostanze, ivi incluse le sostanze attive ad uso farmaceutico, sono raggruppate, in conformità ai criteri di cui all'articolo 14, in cinque tabelle, allegate al presente testo unico. Il Ministero della salute stabilisce con proprio decreto il completamento e l'aggiornamento delle tabelle con le modalità di cui all'articolo 2, comma 1, lettera e), numero 2).»;
b) il comma 3 è abrogato;
c) il comma 5 è sostituito dal seguente:
«5. Il Ministero della salute, sentiti il Consiglio superiore di sanità e la Presidenza del Consiglio dei Ministri-Dipartimento nazionale per le politiche antidroga, ed in accordo con le convenzioni internazionali in materia di sostanze stupefacenti o psicotrope, dispone con apposito decreto l'esclusione da una o più misure di controllo di quei medicinali e dispositivi diagnostici che per la loro composizione qualitativa e quantitativa non possono trovare un uso diverso da quello cui sono destinati.».
3. L'articolo 14 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 14. – (Criteri per la formazione delle tabelle). – 1. La inclusione delle sostanze stupefacenti o psicotrope nelle tabelle di cui all'articolo 13 è effettuata in base ai seguenti criteri:
a) nella tabella I devono essere indicati:
1) l'oppio e i materiali da cui possono essere ottenute le sostanze oppiacee naturali, estraibili dal papavero sonnifero; gli alcaloidi ad azione narcotico-analgesica da esso estraibili; le sostanze ottenute per trasformazione chimica di quelle prima indicate; le sostanze ottenibili per sintesi che siano riconducibili, per struttura chimica o per effetti, a quelle oppiacee precedentemente indicate; eventuali intermedi per la loro sintesi;
2) le foglie di coca e gli alcaloidi ad azione eccitante sul sistema nervoso centrale da queste estraibili; le sostanze ad azione analoga ottenute per trasformazione chimica degli alcaloidi sopra indicati oppure per sintesi;
3) le sostanze di tipo amfetaminico ad azione eccitante sul sistema nervoso centrale;
4) ogni altra sostanza che produca effetti sul sistema nervoso centrale ed abbia capacità di determinare dipendenza fisica o psichica dello stesso ordine o di ordine superiore a quelle precedentemente indicate;
5) gli indolici, siano essi derivati triptaminici che lisergici, e i derivati feniletilamminici, che abbiano effetti allucinogeni o che possano provocare distorsioni sensoriali;
6) i tetraidrocannabinoli, i loro analoghi, le sostanze ottenute per sintesi o semisintesi che siano ad essi riconducibili per struttura chimica o per effetto farmaco-tossicologico;
7) ogni altra pianta o sostanza naturale o sintetica che possa provocare allucinazioni o gravi distorsioni sensoriali e tutte le sostanze ottenute per estrazione o per sintesi chimica che provocano la stessa tipologia di effetti a carico del sistema nervoso centrale;
8) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera e);
b) nella tabella II devono essere indicati:
1) la cannabis indica e i prodotti da essa ottenuti;
2) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera e);
c) nella tabella III devono essere indicati:
1) i barbiturici che hanno notevole capacità di indurre dipendenza fisica o psichica o entrambe, nonché altre sostanze ad effetto ipnotico-sedativo ad essi assimilabili. Sono pertanto esclusi i barbiturici a lunga durata e di accertato effetto antiepilettico e i barbiturici a breve durata di impiego quali anestetici generali, sempre che tutte le dette sostanze non comportino i pericoli di dipendenza innanzi indicati;
2) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera e);
d) nella tabella IV devono essere indicate:
1) le sostanze per le quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica di intensità e gravità minori di quelli prodotti dalle sostanze elencate nelle tabelle I e III;
2) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera e);
e) nella tabella denominata “tabella dei medicinali” e suddivisa in cinque sezioni, sono indicati i medicinali a base di sostanze attive stupefacenti o psicotrope, ivi incluse le sostanze attive ad uso farmaceutico, di corrente impiego terapeutico ad uso umano o veterinario. Nella sezione A della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze analgesiche oppiacee naturali, di semisintesi e di sintesi;
2) i medicinali di cui all'allegato III-bis al presente testo unico;
3) i medicinali contenenti sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di grave dipendenza fisica o psichica;
4) i medicinali contenenti barbiturici che hanno notevole capacità di indurre dipendenza fisica o psichica o entrambe, nonché altre sostanze ad effetto ipnotico-sedativo ad essi assimilabili;
f) nella sezione B della tabella dei medicinali sono indicati:
1) i medicinali che contengono sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica di intensità e gravità minori di quelli prodotti dai medicinali elencati nella sezione A;
2) i medicinali contenenti barbiturici ad azione antiepilettica e quelli contenenti barbiturici con breve durata d'azione;
3) i medicinali contenenti le benzodiazepine, i derivati pirazolopirimidinici ed i loro analoghi ad azione ansiolitica o psicostimolante che possono dar luogo al pericolo di abuso e generare farmacodipendenza;
g) nella sezione C della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze elencate nella tabella dei medicinali, sezione B, da sole o in associazione con altre sostanze attive ad uso farmaceutico, per i quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica;
h) nella sezione D della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze elencate nella tabella dei medicinali, sezioni A o B, da sole o in associazione con altre sostanze attive ad uso farmaceutico quando per la loro composizione qualitativa e quantitativa e per le modalità del loro uso, presentano rischi di abuso o farmacodipendenza di grado inferiore a quello dei medicinali compresi nella tabella dei medicinali, sezioni A e C, e pertanto non sono assoggettate alla disciplina delle sostanze che entrano a far parte della loro composizione;
2) i medicinali ad uso parenterale a base di benzodiazepine;
3) i medicinali per uso diverso da quello iniettabile, i quali, in associazione con altre sostanze attive ad uso farmaceutico non stupefacenti contengono alcaloidi totali dell'oppio con equivalente ponderale in morfina non superiore allo 0,05 per cento in peso espresso come base anidra; i suddetti medicinali devono essere tali da impedire praticamente il recupero dello stupefacente con facili ed estemporanei procedimenti estrattivi;
3-bis) in considerazione delle prioritarie esigenze terapeutiche nei confronti del dolore severo, composti medicinali utilizzati in terapia del dolore elencati nell'allegato III-bis, limitatamente alle forme farmaceutiche diverse da quella parenterale;
i) nella sezione E della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze elencate nella tabella dei medicinali, sezioni A o B, da sole o in associazione con altre sostanze attive ad uso farmaceutico, quando per la loro composizione qualitativa e quantitativa o per le modalità del loro uso, possono dar luogo a pericolo di abuso o generare farmacodipendenza di grado inferiore a quello dei medicinali elencati nella tabella dei medicinali, sezioni A, B, C o D.
2. Nelle tabelle di cui al comma 1 sono compresi, ai fini della applicazione del presente testo unico, tutti gli isomeri, gli esteri, gli eteri, ed i sali anche relativi agli isomeri, esteri ed eteri, nonché gli stereoisomeri nei casi in cui possono essere prodotti, relativi alle sostanze incluse nelle tabelle I, II, III e IV, e ai medicinali inclusi nella tabella dei medicinali, salvo sia fatta espressa eccezione.
3. Le sostanze incluse nelle tabelle sono indicate con la denominazione comune internazionale, il nome chimico, la denominazione comune italiana o l'acronimo, se esiste. È, tuttavia, ritenuto sufficiente, ai fini della applicazione del presente testo unico, che nelle tabelle la sostanza sia indicata con almeno una delle denominazioni sopra indicate, purché idonea ad identificarla.
4. Le sostanze e le piante di cui al comma 1, lettere a) e b), sono soggette alla disciplina del presente testo unico anche ove si presentino sotto ogni forma di prodotto, miscuglio o miscela.
5. La tabella I contiene, nella sezione B, le sostanze già tabellarmente classificate a decorrere dal 27 febbraio 2006.
6. La tabella dei medicinali indica la classificazione ai fini della fornitura. Sono comunque fatte salve le condizioni stabilite dall'Agenzia italiana del farmaco all'atto del rilascio dell'autorizzazione all'immissione in commercio, nonché le limitazioni e i divieti stabiliti dal Ministero della salute per esigenze di salute pubblica.».
4. All'articolo 26 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Salvo quanto stabilito nel comma 2, è vietata nel territorio dello Stato la coltivazione delle piante comprese nelle tabelle I e II di cui all'articolo 14.».
5. All'articolo 31 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 1, le parole: «nelle tabelle I, II, III, IV e V di cui all'articolo 14» sono sostituite dalle seguenti: «nelle tabelle di cui all'articolo 14, con esclusione di quelle incluse nelle sezioni C, D ed E della tabella dei medicinali».
6. All'articolo 34 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Presso ciascun ente o impresa, autorizzati alla fabbricazione di sostanze stupefacenti o psicotrope, comprese nelle tabelle I, II e nella tabella dei medicinali, sezione A, di cui all'articolo 14, devono essere dislocati uno o più militari della Guardia di finanza per il controllo dell'entrata e dell'uscita delle sostanze stupefacenti o psicotrope, nonché per la sorveglianza a carattere continuativo durante i cicli di lavorazione».
7. All'articolo 35 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 1, le parole: «nelle tabelle I, II, III, IV e VI di cui all'articolo 14» sono sostituite dalle seguenti: «nelle tabelle di cui all'articolo 14, con esclusione di quelle incluse nelle sezioni C, D ed E della tabella dei medicinali».
8. All'articolo 36 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «I, II, III, IV e V» sono soppresse;
b) al comma 3, le parole: «delle preparazioni ottenute» sono sostituite dalle seguenti: «dei prodotti ottenuti».
9. All'articolo 38 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
«1. La vendita o cessione, a qualsiasi titolo, anche gratuito, delle sostanze e dei medicinali compresi nelle tabelle di cui all'articolo 14, esclusi i medicinali di cui alla tabella dei medicinali, sezioni D ed E, è fatta alle persone autorizzate ai sensi del presente testo unico in base a richiesta scritta da staccarsi da apposito bollettario “buoni acquisto” conforme al modello predisposto dal Ministero della salute. I titolari o i direttori di farmacie aperte al pubblico o ospedaliere possono utilizzare il bollettario “buoni acquisto” anche per richiedere, a titolo gratuito, i medicinali compresi nella tabella dei medicinali, esclusi i medicinali e le sostanze attive ad uso farmaceutico di cui alla tabella dei medicinali, sezioni D ed E, ad altre farmacie aperte al pubblico o ospedaliere, qualora si configuri il carattere di urgenza terapeutica.»;
b) dopo il comma 1 è inserito il seguente:
«1-bis. Il Ministero della salute dispone, con proprio decreto, il modello di bollettario “buoni acquisto” adatto alle richieste cumulative.».
10. Il comma 1 dell'articolo 40 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«1. Il Ministero della salute, nel rispetto delle normative comunitarie, al momento dell'autorizzazione all'immissione in commercio, determina, in rapporto alla loro composizione, indicazione terapeutica e posologia, le confezioni dei medicinali contenenti sostanze stupefacenti o psicotrope che possono essere messe in commercio ed individua, in applicazione dei criteri di cui all'articolo 14, la sezione della tabella dei medicinali in cui collocare il medicinale stesso.».
11. All'articolo 41 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, lettera d), le parole: «nelle tabelle I e II previste dall'articolo 14» sono sostituite dalle seguenti: «nelle tabelle I, II, III e nella tabella dei medicinali, sezione A, di cui all'articolo 14»;
b) al comma 1-bis, la parola: «farmaci» è sostituita dalla seguente: «medicinali», e le parole: «di pazienti affetti da dolore severo in corso di patologia neoplastica o degenerativa» sono sostituite dalle seguenti: «di malati che hanno accesso alle cure palliative e alla terapia del dolore secondo le vigenti disposizioni».
12. All'articolo 42 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) la rubrica è sostituita dalla seguente: «Acquisto di medicinali a base di sostanze stupefacenti e di sostanze psicotrope da parte di medici chirurghi»;
b) il comma 1 è sostituito dal seguente:
«1. I medici chirurghi ed i medici veterinari, i direttori sanitari o responsabili di ospedali, case di cura in genere, prive dell'unità operativa di farmacia, e titolari di gabinetto per l'esercizio delle professioni sanitarie qualora, per le normali esigenze terapeutiche, si determini la necessità di approvvigionarsi di medicinali a base di sostanze stupefacenti o psicotrope compresi nella tabella dei medicinali, sezioni A, B e C, di cui all'articolo 14, devono farne richiesta scritta in triplice copia alla farmacia o al grossista di medicinali. La prima delle predette copie rimane per documentazione al richiedente; le altre due devono essere rimesse alla farmacia o alla ditta all'ingrosso; queste ultime ne trattengono una per il proprio discarico e trasmettono l'altra all'azienda sanitaria locale a cui fanno riferimento.»;
c) al comma 2, le parole: «delle predette preparazioni» sono sostituite dalle seguenti: «dei predetti medicinali» e le parole: «lire duecentomila a lire un milione» sono sostituite dalle seguenti: «euro 100 ad euro 500»;
d) al comma 3, le parole: «delle preparazioni acquistate» sono sostituite dalle seguenti: «dei medicinali acquistati» e le parole: «delle preparazioni stesse» sono sostituite dalle seguenti: «dei medicinali stessi».
13. L'articolo 43 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 43. – (Obblighi dei medici chirurghi e dei medici veterinari). – 1. I medici chirurghi e i medici veterinari prescrivono i medicinali compresi nella tabella dei medicinali, sezione A, di cui all'articolo 14, su apposito ricettario approvato con decreto del Ministero della salute.
2. La prescrizione dei medicinali indicati nella tabella dei medicinali, sezione A, di cui all'articolo 14 può comprendere un solo medicinale per una cura di durata non superiore a trenta giorni, ad eccezione della prescrizione dei medicinali di cui all'allegato III-bis per i quali la ricetta può comprendere fino a due medicinali diversi tra loro o uno stesso medicinale con due dosaggi differenti per una cura di durata non superiore a trenta giorni.
3. Nella ricetta devono essere indicati:
a) cognome e nome dell'assistito ovvero del proprietario dell'animale ammalato;
b) la dose prescritta, la posologia ed il modo di somministrazione;
c) l'indirizzo e il numero telefonico professionali del medico chirurgo o del medico veterinario da cui la ricetta è rilasciata;
d) la data e la firma del medico chirurgo o del medico veterinario da cui la ricetta è rilasciata;
e) il timbro personale del medico chirurgo o del medico veterinario da cui la ricetta è rilasciata.
4. Le ricette di cui al comma 1 sono compilate in duplice copia a ricalco per i medicinali non forniti dal Servizio sanitario nazionale, ed in triplice copia a ricalco per i medicinali forniti dal Servizio sanitario nazionale. Una copia della ricetta è comunque conservata dall'assistito o dal proprietario dell'animale ammalato. Il Ministero della salute stabilisce con proprio decreto la forma ed il contenuto del ricettario di cui al comma 1.
4-bis. Per la prescrizione, nell'ambito del Servizio sanitario nazionale, di farmaci previsti dall'allegato III-bis per il trattamento di pazienti affetti da dolore severo, in luogo del ricettario di cui al comma 1, contenente le ricette a ricalco di cui al comma 4, può essere utilizzato il ricettario del Servizio sanitario nazionale, disciplinato dal decreto del Ministro dell'economia e delle finanze 17 marzo 2008, pubblicato nel supplemento ordinario alla Gazzetta Ufficiale n. 86 dell'11 aprile 2008. Il Ministro della salute, sentiti il Consiglio superiore di sanità e la Presidenza del Consiglio dei ministri - Dipartimento per le politiche antidroga, può, con proprio decreto, aggiornare l'elenco dei farmaci di cui all'allegato III-bis.
5. La prescrizione dei medicinali compresi nella tabella dei medicinali, sezione A, di cui all'articolo 14, qualora utilizzati per il trattamento di disassuefazione dagli stati di tossicodipendenza da oppiacei o di alcooldipendenza, è effettuata utilizzando il ricettario di cui al comma 1 nel rispetto del piano terapeutico predisposto da una struttura sanitaria pubblica o da una struttura privata autorizzata ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi di cui al comma 2, lettera d), del medesimo articolo. La persona alla quale sono consegnati in affidamento i medicinali di cui al presente comma è tenuta ad esibire a richiesta la prescrizione medica o il piano terapeutico in suo possesso.
6. I medici chirurghi e i medici veterinari sono autorizzati ad approvvigionarsi attraverso autoricettazione, a trasportare e a detenere i medicinali compresi nell'allegato III-bis per uso professionale urgente, utilizzando il ricettario di cui al comma 1. Una copia della ricetta è conservata dal medico chirurgo o dal medico veterinario che tiene un registro delle prestazioni effettuate, annotandovi le movimentazioni, in entrata ed uscita, dei medicinali di cui si è approvvigionato e che successivamente ha somministrato. Il registro delle prestazioni non è di modello ufficiale e deve essere conservato per due anni a far data dall'ultima registrazione effettuata; le copie delle autoricettazioni sono conservate, come giustificativo dell'entrata, per lo stesso periodo del registro.
7. Il personale che opera nei distretti sanitari di base o nei servizi territoriali o negli ospedali pubblici o accreditati delle aziende sanitarie locali è autorizzato a consegnare al domicilio di malati che hanno accesso alle cure palliative e alla terapia del dolore secondo le vigenti disposizioni, ad esclusione del trattamento domiciliare degli stati di tossicodipendenza da oppiacei, le quantità terapeutiche dei medicinali compresi nell'allegato III-bis accompagnate dalla certificazione medica che ne prescrive la posologia e l'utilizzazione nell'assistenza domiciliare.
8. Gli infermieri professionali che effettuano servizi di assistenza domiciliare nell'ambito dei distretti sanitari di base o nei servizi territoriali delle aziende sanitarie locali e i familiari dei pazienti, opportunamente identificati dal medico o dal farmacista che ivi effettuano servizio, sono autorizzati a trasportare le quantità terapeutiche dei medicinali compresi nell'allegato III-bis accompagnate dalla certificazione medica che ne prescrive la posologia e l'utilizzazione a domicilio di malati che hanno accesso alle cure palliative e alla terapia del dolore secondo le vigenti disposizioni, ad esclusione del trattamento domiciliare degli stati di tossicodipendenza da oppiacei.
9. La prescrizione dei medicinali compresi nella tabella dei medicinali, sezioni B, C e D, di cui all'articolo 14 è effettuata con ricetta da rinnovarsi volta per volta e da trattenersi da parte del farmacista.
10. La prescrizione dei medicinali compresi nella tabella dei medicinali, sezione E, di cui all'articolo 14 è effettuata con ricetta medica.».
14. L'articolo 45 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 45. – (Dispensazione dei medicinali). – 1. La dispensazione dei medicinali compresi nella tabella dei medicinali, sezione A, di cui all'articolo 14 è effettuata dal farmacista che annota sulla ricetta il nome, il cognome e gli estremi di un documento di riconoscimento dell'acquirente.
2. Il farmacista dispensa i medicinali di cui al comma 1 dietro presentazione di prescrizione medica compilata sulle ricette previste dai commi 1 e 4-bis dell'articolo 43 nella quantità e nella forma farmaceutica prescritta.
3. Il farmacista ha l'obbligo di accertare che la ricetta sia stata redatta secondo le disposizioni stabilite nell'articolo 43, di annotarvi la data di spedizione e di apporvi il timbro della farmacia e di conservarla tenendone conto ai fini del discarico dei medicinali sul registro di entrata e uscita di cui al comma 1 dell'articolo 60.
3-bis. Il farmacista spedisce comunque le ricette che prescrivano un quantitativo che, in relazione alla posologia indicata, superi teoricamente il limite massimo di terapia di trenta giorni, ove l'eccedenza sia dovuta al numero di unità posologiche contenute nelle confezioni in commercio. In caso di ricette che prescrivano una cura di durata superiore a trenta giorni, il farmacista consegna un numero di confezioni sufficiente a coprire trenta giorni di terapia, in relazione alla posologia indicata, dandone comunicazione al medico prescrittore.
4. La dispensazione dei medicinali di cui alla tabella dei medicinali, sezioni B e C, è effettuata dal farmacista dietro presentazione di ricetta medica da rinnovarsi volta per volta. Il farmacista appone sulla ricetta la data di spedizione e il timbro della farmacia e la conserva tenendone conto ai fini del discarico dei medicinali sul registro di entrata e di uscita di cui all'articolo 60, comma 1.
5. Il farmacista conserva per due anni, a partire dal giorno dell'ultima registrazione nel registro di cui all'articolo 60, comma 1, le ricette che prescrivono medicinali compresi nella tabella dei medicinali, sezioni A, B e C. Nel caso di fornitura di medicinali a carico del Servizio sanitario nazionale, il farmacista è tenuto a conservare una copia della ricetta originale o fotocopia della ricetta originale, recante la data di spedizione.
6. La dispensazione dei medicinali di cui alla tabella dei medicinali, sezione D, è effettuata dal farmacista dietro presentazione di ricetta medica da rinnovarsi volta per volta.
6-bis. All'atto della dispensazione dei medicinali inseriti nella sezione D della tabella dei medicinali, successivamente alla data del 15 giugno 2009, limitatamente alle ricette diverse da quella di cui al decreto del Ministro della salute 10 marzo 2006, pubblicato nella Gazzetta Ufficiale n. 76 del 31 marzo 2006, o da quella del Servizio sanitario nazionale, disciplinata dal decreto del Ministro dell'economia e delle finanze 17 marzo 2008, pubblicato nel supplemento ordinario alla Gazzetta Ufficiale n. 86 dell'11 aprile 2008, il farmacista deve annotare sulla ricetta il nome, il cognome e gli estremi di un documento di riconoscimento dell'acquirente. Il farmacista conserva per due anni, a partire dal giorno dell'ultima registrazione, copia o fotocopia della ricetta ai fini della dimostrazione della liceità del possesso dei farmaci consegnati dallo stesso farmacista al paziente o alla persona che li ritira.
7. La dispensazione dei medicinali di cui alla tabella dei medicinali, sezione E, è effettuata dal farmacista dietro presentazione di ricetta medica.
8. Decorsi trenta giorni dalla data del rilascio, la prescrizione medica non può essere più spedita.
9. Salvo che il fatto costituisca reato, il contravventore alle disposizioni del presente articolo è soggetto alla sanzione amministrativa pecuniaria del pagamento di una somma da euro 100 ad euro 600.
10. Il Ministro della salute provvede a stabilire, con proprio decreto, tenuto conto di quanto previsto dal decreto ministeriale 15 luglio 2004 in materia di tracciabilità di medicinali, la forma ed il contenuto dei moduli idonei al controllo del movimento dei medicinali a base di sostanze stupefacenti o psicotrope tra le farmacie interne degli ospedali e singoli reparti.
10-bis. Su richiesta del cliente e in caso di ricette che prescrivono più confezioni, il farmacista, previa specifica annotazione sulla ricetta, può spedirla in via definitiva consegnando un numero di confezioni inferiore a quello prescritto, dandone comunicazione al medico prescrittore, ovvero può consegnare, in modo frazionato, le confezioni, purché entro il termine di validità della ricetta e previa annotazione del numero di confezioni volta per volta consegnato.».
15. All'articolo 46 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «delle preparazioni indicate nelle tabelle I, II, III, IV e V previste» sono sostituite dalle seguenti: «dei medicinali compresi nella tabella dei medicinali, sezioni A, B, C e D, prevista»;
b) al comma 4, le parole: «delle preparazioni» sono sostituite dalle seguenti: «dei medicinali».
16. All'articolo 47 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «delle preparazioni indicate nelle tabelle I, II, III, IV e V previste» sono sostituite dalle seguenti: «dei medicinali compresi nella tabella dei medicinali, sezioni A, B, C e D, prevista»;
b) al comma 4, le parole: «delle preparazioni» sono sostituite dalle seguenti: «dei medicinali».
17. All'articolo 54 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «tabelle I, II, III, IV e V di cui all'articolo 14» sono sostituite dalle seguenti: «tabelle di cui all'articolo 14, con esclusione dei medicinali di cui alle sezioni C, D ed E della tabella dei medicinali,»;
b) al comma 2, le parole: «I, II, e III previste dall'articolo 14» sono sostituite dalle seguenti: «di cui all'articolo 14, con esclusione dei medicinali di cui alle sezioni B, C, D ed E della tabella dei medicinali,».
18. L'articolo 60 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 60. – (Registro di entrata e uscita). – 1. Ogni acquisto o cessione, anche a titolo gratuito, di sostanze e di medicinali di cui alle tabelle previste dall'articolo 14, è iscritto in un registro speciale nel quale, senza alcuna lacuna, abrasione o aggiunta, in ordine cronologico, secondo una progressione numerica unica per ogni sostanza o medicinale, è tenuto in evidenza il movimento di entrata e di uscita delle stesse sostanze o medicinali. Tale registro è numerato e firmato in ogni pagina dal responsabile dell'azienda unità sanitaria locale o da un suo delegato che riporta nella prima pagina gli estremi della autorizzazione ministeriale e dichiara nell'ultima il numero delle pagine di cui il registro è costituito. Il registro è conservato da parte degli enti e delle imprese autorizzati alla fabbricazione, per la durata di dieci anni dal giorno dell'ultima registrazione. Detto termine è ridotto a cinque anni per le officine autorizzate all'impiego e per le imprese autorizzate al commercio all'ingrosso. Lo stesso termine è ridotto a due anni per le farmacie aperte al pubblico e per le farmacie ospedaliere. I direttori sanitari e i titolari di gabinetto di cui all'articolo 42, comma 1, conservano il registro di cui al presente comma per due anni dal giorno dell'ultima registrazione.
2. I responsabili delle farmacie aperte al pubblico e delle farmacie ospedaliere nonché delle aziende autorizzate al commercio all'ingrosso riportano sul registro il movimento dei medicinali di cui alla tabella dei medicinali, sezioni A, B e C, secondo le modalità indicate al comma 1 e nel termine di quarantotto ore dalla dispensazione.
3. Le unità operative delle strutture sanitarie pubbliche e private, nonché le unità operative dei servizi territoriali delle aziende sanitarie locali sono dotate di registro di carico e scarico dei medicinali di cui alla tabella dei medicinali, sezioni A, B e C, prevista dall'articolo 14.
4. I registri di cui ai commi 1 e 3 sono conformi ai modelli predisposti dal Ministero della salute e possono essere composti da un numero di pagine adeguato alla quantità di stupefacenti normalmente detenuti e movimentati.
5. In alternativa ai registri di cui ai commi 1 e 3, il Ministero della salute stabilisce con proprio decreto le modalità di registrazione su supporto informatico della movimentazione delle sostanze e dei medicinali di cui alle tabelle previste dall'articolo 14.
6. Il registro di cui al comma 3 è vidimato dal direttore sanitario, o da un suo delegato, che provvede alla sua distribuzione. Il registro è conservato, in ciascuna unità operativa, dal responsabile dell'assistenza infermieristica per due anni dalla data dell'ultima registrazione.
7. Il dirigente medico preposto all'unità operativa è responsabile della effettiva corrispondenza tra la giacenza contabile e quella reale dei medicinali di cui alla tabella dei medicinali, sezioni A, B e C, prevista dall'articolo 14.
8. Il direttore responsabile del servizio farmaceutico compie periodiche ispezioni per accertare la corretta tenuta dei registri di reparto di cui al comma 3 e redige apposito verbale da trasmettere alla direzione sanitaria.».
19. All'articolo 61 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Nel registro di cui all'articolo 60, comma 1, tenuto da enti e imprese autorizzati alla fabbricazione di sostanze stupefacenti o psicotrope nonché dei medicinali, compresi nelle tabelle di cui all'articolo 14, è annotata ciascuna operazione di entrata e di uscita o di passaggio in lavorazione.».
20. All'articolo 62 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Il registro di cui all'articolo 60, comma 1, tenuto dagli enti e imprese autorizzati all'impiego ed al commercio di sostanze stupefacenti o psicotrope nonché dei medicinali di cui alle tabelle previste dall'articolo 14 ed il registro delle farmacie per quanto concerne i medicinali di cui alla tabella dei medicinali, sezioni A, B e C, dell'articolo 14, sono chiusi al 31 dicembre di ogni anno. La chiusura si compie mediante scritturazione riassuntiva di tutti i dati comprovanti i totali delle qualità e quantità dei prodotti avuti in carico e delle quantità e qualità dei prodotti impiegati o commercializzati durante l'anno, con l'indicazione di ogni eventuale differenza o residuo.».
21. All'articolo 63 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Gli enti o le imprese autorizzati alla fabbricazione di sostanze stupefacenti o psicotrope nonché dei medicinali compresi nelle tabelle di cui all'articolo 14 tengono anche un registro di lavorazione, numerato e firmato in ogni pagina da un funzionario del Ministero della salute all'uopo delegato, nel quale sono iscritte le quantità di materie prime poste in lavorazione, con indicazione della loro esatta denominazione e della data di entrata nel reparto di lavorazione, nonché i prodotti ottenuti da ciascuna lavorazione. Tale registro è conservato per dieci anni a far data dall'ultima registrazione.».
22. Il comma 1 dell'articolo 65 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«1. Gli enti e le imprese autorizzati alla produzione, alla fabbricazione e all'impiego di sostanze stupefacenti o psicotrope nonché dei medicinali, compresi nelle tabelle di cui all'articolo 14, trasmettono al Ministero della salute, alla Direzione centrale per i servizi antidroga e alla competente unità sanitaria locale annualmente, non oltre il 31 gennaio di ciascun anno, i dati riassuntivi dell'anno precedente e precisamente:
a) i risultati di chiusura del registro di carico e scarico;
b) la quantità e qualità delle sostanze utilizzate per la produzione di medicinali preparati nel corso dell'anno;
c) la quantità e la qualità dei medicinali venduti nel corso dell'anno;
d) la quantità e la qualità delle giacenze esistenti al 31 dicembre.».
23. All'articolo 66 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Gli enti e le imprese autorizzati ai sensi dell'articolo 17 che abbiano effettuato importazioni o esportazioni di sostanze stupefacenti o psicotrope nonché di medicinali compresi nelle tabelle di cui all'articolo 14, trasmettono al Ministero della salute, entro quindici giorni dalla fine di ogni trimestre, i dati relativi ai permessi di importazione o di esportazione utilizzati nel corso del trimestre precedente. Gli enti e le imprese autorizzati alla fabbricazione trasmettono, altresì, un rapporto sulla natura e quantità delle materie prime ricevute e di quelle utilizzate per la lavorazione degli stupefacenti o sostanze psicotrope nonché dei medicinali ricavati, e di quelli venduti nel corso del trimestre precedente. In tale rapporto, per l'oppio grezzo, nonché per le foglie e pasta di coca è indicato il titolo in sostanze attive ad azione stupefacente.».
24. Gli articoli 69 e 71 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono abrogati.
25. All'articolo 114 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 2 è sostituito dal seguente:
«2. Il perseguimento degli obiettivi previsti dal comma 1 può essere affidato dai comuni e dalle comunità montane o dalle loro associazioni alle competenti aziende unità sanitarie locali o alle strutture private autorizzate ai sensi dell'articolo 116.».
26. All'articolo 115 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 1 la parola: «ausiliari» è soppressa.
27. All'articolo 120 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
«1. Chiunque fa uso di sostanze stupefacenti e di sostanze psicotrope può chiedere al servizio pubblico per le tossicodipendenze o ad una struttura privata autorizzata ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi, di cui al comma 2, lettera d), del medesimo articolo di essere sottoposto ad accertamenti diagnostici e di eseguire un programma terapeutico e socio-riabilitativo.»;
b) al comma 3, le parole: «dell'unità» sono sostituite dalle seguenti: «delle aziende unità» e dopo le parole: «unità sanitarie locali,» sono inserite le seguenti: «e con le strutture private autorizzate ai sensi dell'articolo 116.»;
c) il comma 4 è sostituito dal seguente:
«4. Gli esercenti la professione medica che assistono persone dedite all'uso di sostanze stupefacenti e di sostanze psicotrope possono, in ogni tempo, avvalersi dell'ausilio del servizio pubblico per le tossicodipendenze e delle strutture private autorizzate ai sensi dell'articolo 116.»;
d) il comma 7 è sostituito dal seguente:
«7. Gli operatori del servizio pubblico per le tossicodipendenze e delle strutture private autorizzate ai sensi dell'articolo 116, salvo l'obbligo di segnalare all'autorità competente tutte le violazioni commesse dalla persona sottoposta al programma terapeutico alternativo a sanzioni amministrative o ad esecuzione di pene detentive, non possono essere obbligati a deporre su quanto hanno conosciuto per ragione della propria professione, né davanti all'autorità giudiziaria né davanti ad altra autorità. Agli stessi si applicano le disposizioni dell'articolo 200 del codice di procedura penale e si estendono le garanzie previste per il difensore dalle disposizioni dell'articolo 103 del codice di procedura penale in quanto applicabili.».
28. All'articolo 122 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
«1. Il servizio pubblico per le tossicodipendenze e le strutture private autorizzate ai sensi dell'articolo 116, compiuti i necessari accertamenti e sentito l'interessato, che può farsi assistere da un medico di fiducia autorizzato a presenziare anche agli accertamenti necessari, definiscono un programma terapeutico e socio-riabilitativo personalizzato che può prevedere, ove le condizioni psicofisiche del tossicodipendente lo consentano, in collaborazione con i centri di cui all'articolo 114 e avvalendosi delle cooperative di solidarietà sociale e delle associazioni di cui all'articolo 115, iniziative volte ad un pieno inserimento sociale attraverso l'orientamento e la formazione professionale, attività di pubblica utilità o di solidarietà sociale. Nell’àmbito dei programmi terapeutici che lo prevedono, possono adottare metodologie di disassuefazione, nonché trattamenti psico-sociali e farmacologici adeguati. Il servizio per le tossicodipendenze controlla l'attuazione del programma da parte del tossicodipendente.»;
b) al comma 2, le parole: «deve essere» sono sostituite dalla seguente: «viene» e dopo la parola: «studio» è inserita la seguente: «e»;
c) al comma 3, le parole: «riabilitative iscritte in un albo regionale o provinciale» sono sostituite dalle seguenti: «private autorizzate ai sensi dell'articolo 116»;
d) il comma 4 è sostituito dal seguente:
«4. Quando l'interessato ritenga di attuare il programma presso strutture private autorizzate ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi, di cui al comma 2, lettera d), del medesimo articolo, la scelta può cadere su qualsiasi struttura situata nel territorio nazionale che si dichiari di essere in condizioni di accoglierlo.».
29. All'articolo 127 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 8 è sostituito dal seguente:
«8. I progetti di cui alle lettere a) e c) del comma 7 non possono prevedere la somministrazione delle sostanze stupefacenti o psicotrope incluse nelle tabelle I e II di cui all'articolo 14 e delle sostanze non inserite nella Farmacopea ufficiale, fatto salvo l'uso dei medicinali oppioidi prescrivibili, purché i dosaggi somministrati e la durata del trattamento abbiano l'esclusiva finalità clinico-terapeutica di avviare gli utenti a successivi programmi riabilitativi.».
30. Al testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono inserite le tabelle, previste dagli articoli 13, comma 1, e 14 del citato testo unico, come modificati dai commi 2 e 3 del presente articolo, nonché l'allegato III-bis, riportati nell'allegato A al presente decreto.
ART. 2.
(Efficacia degli atti amministrativi adottati ai sensi del decreto del Presidente della Repubblica 9 ottobre 1990, n. 309).
1. A decorrere dalla data di entrata in vigore del presente decreto continuano a produrre effetti gli atti amministrativi adottati sino alla data di pubblicazione della sentenza della Corte Costituzionale n. 32 del 12 febbraio 2014, ai sensi del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, e successive modificazioni.
Capo II
IMPIEGO DEI MEDICINALI MENO ONEROSI DA PARTE DEL SERVIZIO SANITARIO NAZIONALE
ART. 3.
(Disposizioni dirette a favorire l'impiego dei medicinali meno onerosi da parte del Servizio sanitario nazionale).
1. Dopo il comma 4 dell'articolo 1 del decreto-legge 21 ottobre 1996, n. 536, convertito dalla legge 23 dicembre 1996, n. 648, sono inseriti i seguenti:
«4-bis. Nel caso in cui l'Autorizzazione all'immissione in commercio di un medicinale non comprenda un'indicazione terapeutica per la quale si ravvisi un motivato interesse pubblico all'utilizzo, l'Agenzia Italiana del Farmaco può procedere, nei limiti delle risorse del fondo di cui all'articolo 48, comma 18, del decreto-legge 30 settembre 2003, n. 269, convertito, con modificazioni, dalla legge 24 novembre 2003, n. 236, destinate alle finalità di cui al comma 19, lettera b), numero 3), alla registrazione della medesima, previa cessione a titolo gratuito al Ministero della salute dei diritti su tale indicazione da parte del titolare dell'AIC o altro avente causa. Qualora il titolare dell'AIC o altro avente causa dichiari di voler procedere direttamente alla registrazione dell'indicazione di interesse, sono definiti con l'Agenzia Italiana del Farmaco i termini e le modalità di avvio degli studi registrativi relativi alla medesima indicazione. Nel caso in cui il titolare dell'autorizzazione all'immissione in commercio o altro avente causa si opponga immotivatamente alla registrazione dell'indicazione terapeutica di interesse pubblico ne viene data adeguata informativa nel sito istituzionale dell'AIFA.
4-ter. Anche se sussista altra alternativa terapeutica nell'ambito dei farmaci autorizzati, l'indicazione terapeutica per la quale sia stato avviato l’iter di registrazione ai sensi del comma 4-bis può essere inserita provvisoriamente nell'elenco di cui al precedente comma 4 con conseguente erogazione dello stesso a carico del Servizio sanitario nazionale, nel caso in cui, a giudizio della Commissione tecnico-scientifica dell'AIFA, tenuto anche conto dei risultati delle eventuali sperimentazioni e ricerche condotte nell'ambito della comunità medico-scientifica nazionale e internazionale, nonché della relativa onerosità del farmaco autorizzato per il Servizio sanitario nazionale, il farmaco sia sicuro ed efficace con riferimento all'impiego proposto rispetto a quello autorizzato. In tal caso AIFA attiva idonei strumenti di monitoraggio a tutela della sicurezza dei pazienti ed assume tempestivamente le necessarie determinazioni.
4-quater. L'inserimento provvisorio ai sensi del comma 4-ter è disposto in attesa che siano disponibili i risultati delle sperimentazioni cliniche condotte sul farmaco e diviene definitivo previa valutazione positiva della Commissione tecnico-scientifica dell'AIFA ai sensi dell'articolo 2, comma 349, della legge 24 dicembre 2007, n. 244.».
ART. 4.
(Entrata in vigore).
1. Il presente decreto entra in vigore il giorno stesso della sua pubblicazione nella Gazzetta Ufficiale della Repubblica italiana e sarà presentato alle Camere per la conversione in legge.
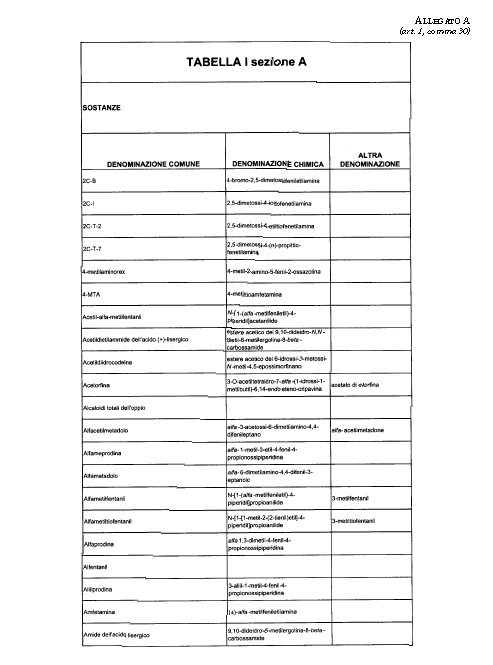
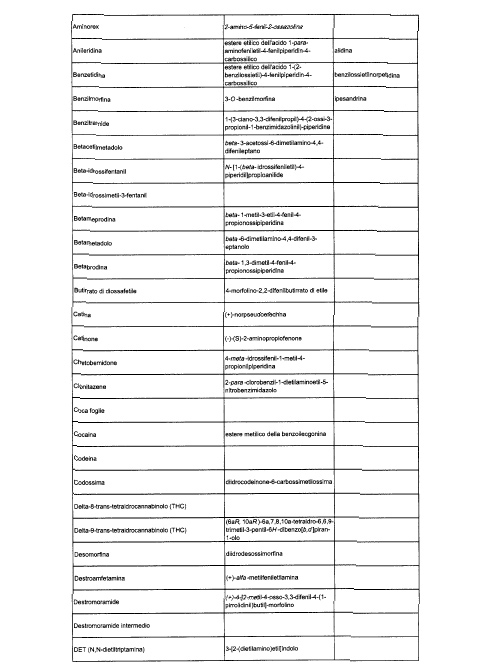
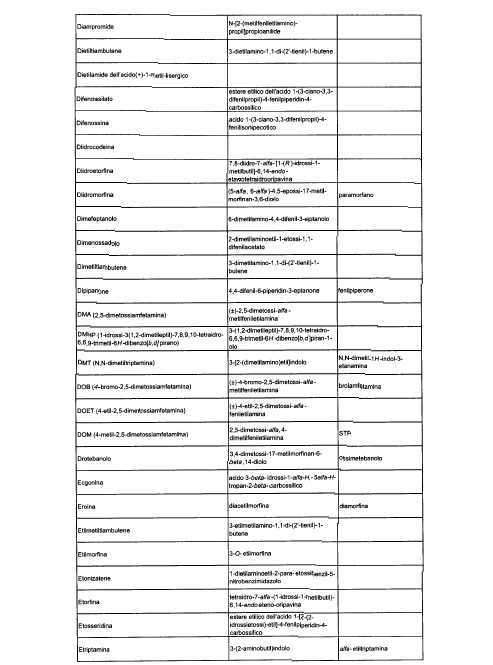
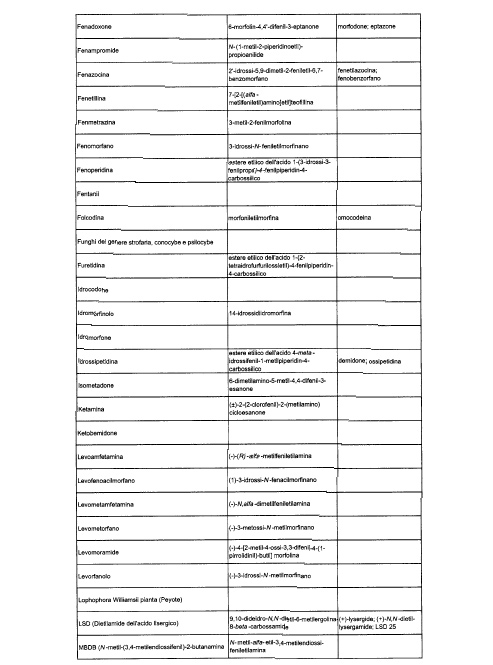
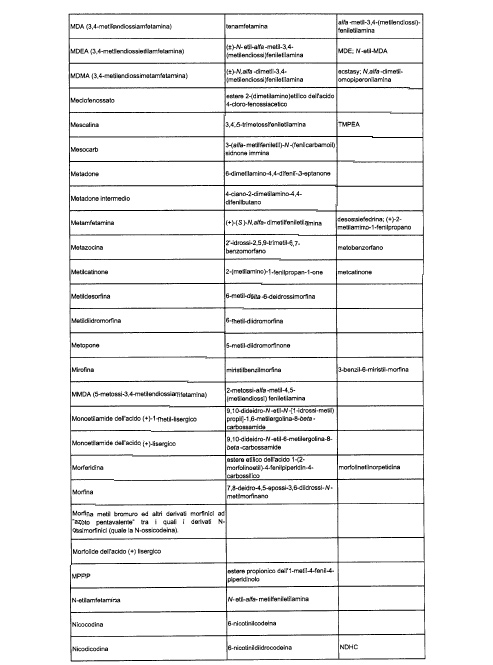
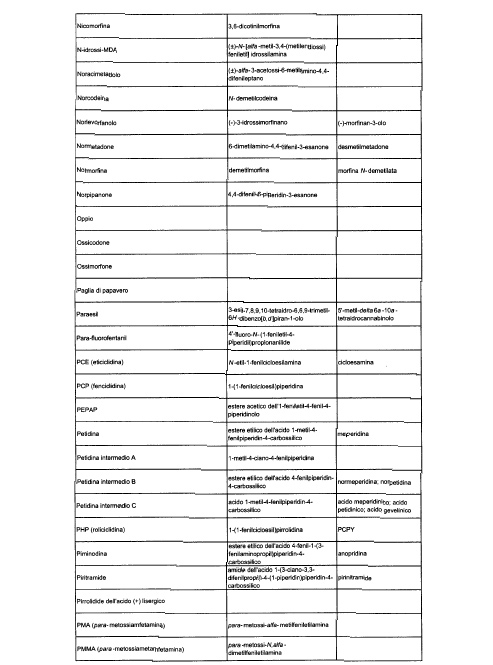
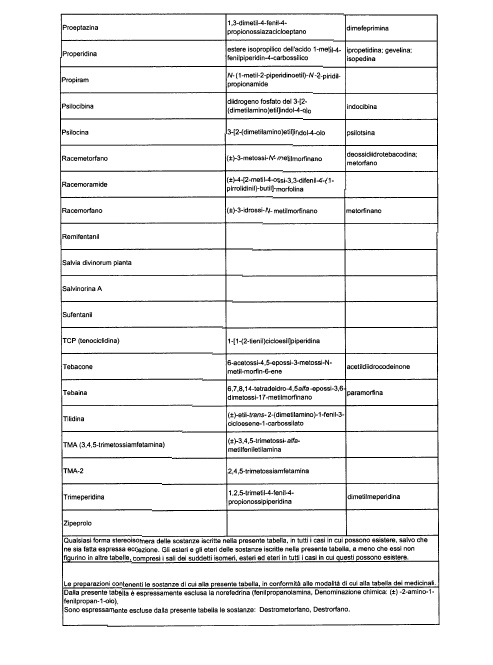
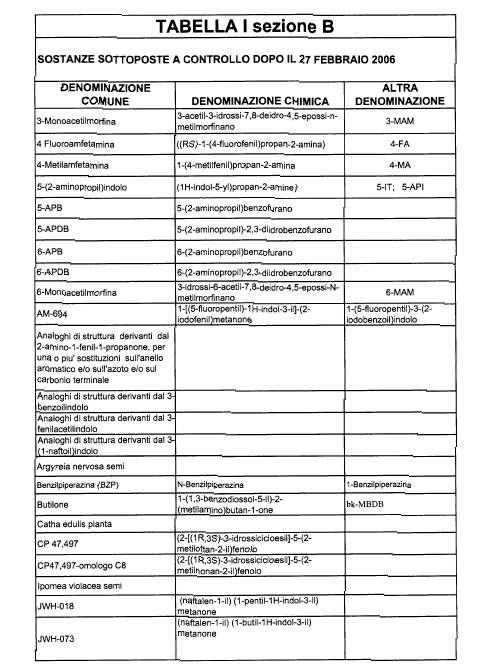







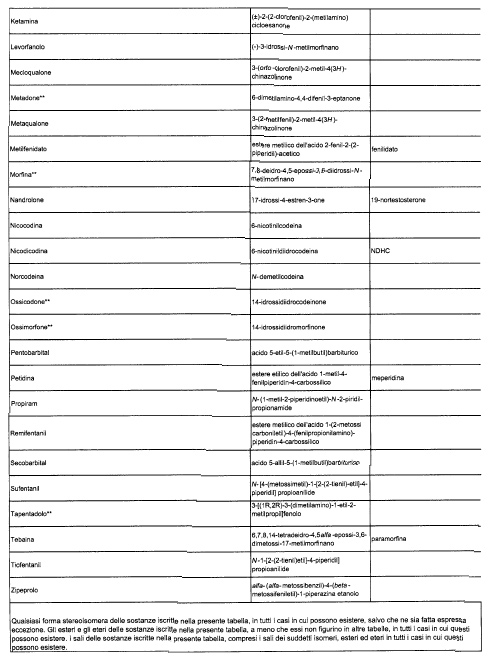
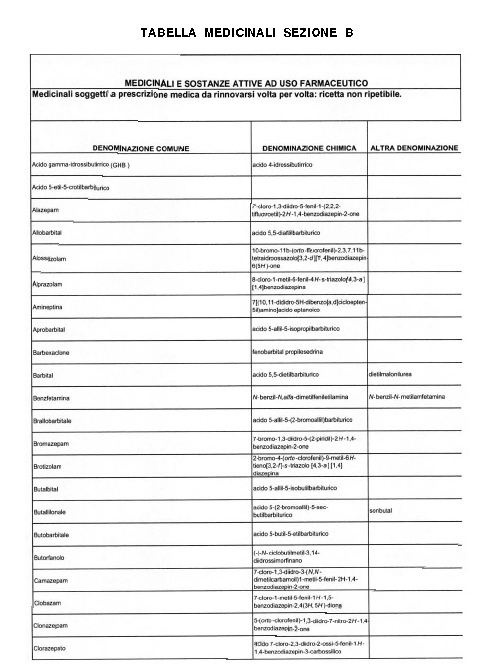
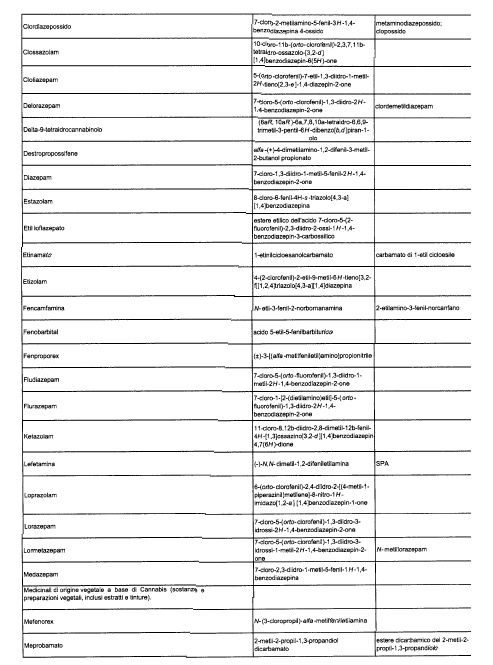
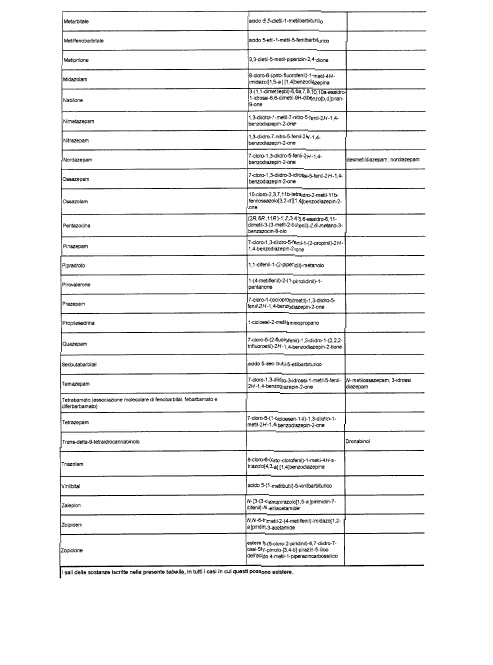




A.C. 2215-A/R – Modificazioni delle Commissioni
MODIFICAZIONI APPORTATE DALLE COMMISSIONI
All'articolo 1:
al comma 1, lettera a), le parole: «la Presidenza del Consiglio dei ministri – Dipartimento nazionale per le politiche antidroga» sono sostituite dalle seguenti: «l'Istituto superiore di sanità»;
al comma 2, lettera c), capoverso 5, le parole: «la Presidenza del Consiglio dei Ministri – Dipartimento nazionale per le politiche antidroga» sono sostituite dalle seguenti: «l'Istituto superiore di sanità»;
al comma 3, capoverso Art. 14:
al comma 1:
alla lettera a), il numero 6) è sostituito dal seguente:
«6) le sostanze ottenute per sintesi o semisintesi che siano riconducibili per struttura chimica o per effetto farmaco-tossicologico al tetraidrocannabinolo»;
alla lettera b), numero 1), la parola: «indica» è soppressa;
il comma 5 è soppresso;
dopo il comma 3 è inserito il seguente:
«3-bis. Al comma 2 dell'articolo 19 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è aggiunto, in fine, il seguente periodo: “Le autorizzazioni non possono essere rilasciate ai soggetti di cui al presente comma, persone fisiche o legali rappresentanti di enti, che abbiano avuto condanne o sanzioni ai sensi degli articoli 73, 74 e 75; in tali casi sono immediatamente revocate anche le autorizzazioni già rilasciate”»;
al comma 4, capoverso 1, sono aggiunte, in fine, le seguenti parole: «, con esclusione della canapa coltivata esclusivamente per la produzione di fibre o per altri usi industriali, diversi da quelli di cui all'articolo 27, consentiti dalla normativa dell'Unione europea»;
al comma 9:
alla lettera a), capoverso 1, le parole: «da staccarsi da apposito bollettario “buoni acquisto”» sono sostituite dalle seguenti: «con buono acquisto» e le parole: «il bollettario “buoni acquisto”» sono sostituite dalle seguenti: «i buoni acquisto»;
alla lettera b), il capoverso 1-bis è sostituito dal seguente:
«1-bis. Il Ministero della salute stabilisce con proprio decreto il modello dei buoni acquisto»;
dopo il comma 9 è inserito il seguente:
«9-bis. L'articolo 39 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è abrogato»;
al comma 13, capoverso Art. 43:
al comma 4-bis:
al primo periodo, la parola: «farmaci» è sostituita dalla seguente: «medicinali»;
al secondo periodo, le parole: «la Presidenza del Consiglio dei ministri – Dipartimento per le politiche antidroga» sono sostituite dalle seguenti: «l'Istituto superiore di sanità» e la parola: «farmaci» è sostituita dalla seguente: «medicinali»;
al comma 5, le parole: «di disassuefazione dagli» sono sostituite dalla seguente: «degli»;
dopo il comma 5 è inserito il seguente:
«5-bis. La prescrizione di medicinali compresi nella tabella dei medicinali, sezione A, per il trattamento degli stati di tossicodipendenza da oppiacei deve essere effettuata all'interno del piano terapeutico individualizzato, secondo modalità stabilite con decreto del Ministero della salute»;
dopo il comma 10 è aggiunto il seguente:
«10-bis. I medici chirurghi, su richiesta dei pazienti in corso di trattamento terapeutico con medicinali stupefacenti o psicotropi che si recano all'estero, provvedono alla redazione della certificazione di possesso dei medicinali stupefacenti o psicotropi compresi nella tabella dei medicinali da presentare all'autorità doganale all'uscita dal territorio nazionale, individuati con decreto del Ministero della salute, che definisce anche il modello della certificazione»;
dopo il comma 16 è inserito il seguente:
«16-bis. Al comma 9 dell'articolo 50 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, le parole: “I, II, III, IV e V” sono sostituite dalle seguenti: “I, II, III e IV”»;
dopo il comma 24 sono inseriti i seguenti:
«24-bis. La rubrica del titolo VII del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituita dalla seguente: “Prescrizioni particolari relative ai precursori di droghe”.
24-ter. All'articolo 73 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, e successive modificazioni, sono apportate le seguenti modificazioni:
a) il comma 5 è sostituito dal seguente:
“5. Salvo che il fatto costituisca più grave reato, chiunque commette uno dei fatti previsti dal presente articolo che, per i mezzi, la modalità o le circostanze dell'azione ovvero per la qualità e quantità delle sostanze, è di lieve entità, è punito con le pene della reclusione da sei mesi a quattro anni e della multa da euro 1.032 a euro 10.329”;
b) dopo il comma 5 è inserito il seguente:
“5-bis. Nell'ipotesi di cui al comma 5, limitatamente ai reati di cui al presente articolo commessi da persona tossicodipendente o da assuntore di sostanze stupefacenti o psicotrope, il giudice, con la sentenza di condanna o di applicazione della pena su richiesta delle parti a norma dell'articolo 444 del codice di procedura penale, su richiesta dell'imputato e sentito il pubblico ministero, qualora non debba concedersi il beneficio della sospensione condizionale della pena, può applicare, anziché le pene detentive e pecuniarie, quella del lavoro di pubblica utilità di cui all'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, secondo le modalità ivi previste. Con la sentenza il giudice incarica l'ufficio locale di esecuzione penale esterna di verificare l'effettivo svolgimento del lavoro di pubblica utilità. L'ufficio riferisce periodicamente al giudice. In deroga a quanto disposto dal citato articolo 54 del decreto legislativo n. 274 del 2000, il lavoro di pubblica utilità ha una durata corrispondente a quella della sanzione detentiva irrogata. Esso può essere disposto anche nelle strutture private autorizzate ai sensi dell'articolo 116, previo consenso delle stesse. In caso di violazione degli obblighi connessi allo svolgimento del lavoro di pubblica utilità, in deroga a quanto previsto dal citato articolo 54 del decreto legislativo n. 274 del 2000, su richiesta del pubblico ministero o d'ufficio, il giudice che procede, o quello dell'esecuzione, con le formalità di cui all'articolo 666 del codice di procedura penale, tenuto conto dell'entità dei motivi e delle circostanze della violazione, dispone la revoca della pena con conseguente ripristino di quella sostituita. Avverso tale provvedimento di revoca è ammesso ricorso per cassazione, che non ha effetto sospensivo. Il lavoro di pubblica utilità può sostituire la pena per non più di due volte”.
24-quater. All'articolo 75 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, e successive modificazioni, sono apportate le seguenti modificazioni:
a) al comma 1, l'alinea è sostituito dal seguente: “Chiunque, per farne uso personale, illecitamente importa, esporta, acquista, riceve a qualsiasi titolo o comunque detiene sostanze stupefacenti o psicotrope è sottoposto, per un periodo da due mesi a un anno, se si tratta di sostanze stupefacenti o psicotrope comprese nelle tabelle I e III previste dall'articolo 14, e per un periodo da uno a tre mesi, se si tratta di sostanze stupefacenti o psicotrope comprese nelle tabelle II e IV previste dallo stesso articolo, a una o più delle seguenti sanzioni amministrative:”;
b) dopo il comma 1 è inserito il seguente:
“1-bis. Ai fini dell'accertamento della destinazione ad uso esclusivamente personale della sostanza stupefacente o psicotropa o del medicinale di cui al comma 1, si tiene conto delle seguenti circostanze:
a) che la quantità di sostanza stupefacente o psicotropa non sia superiore ai limiti massimi indicati con decreto del Ministro della salute, di concerto con il Ministro della giustizia, sentita la Presidenza del Consiglio dei ministri – Dipartimento per le politiche antidroga, nonché della modalità di presentazione delle sostanze stupefacenti o psicotrope, avuto riguardo al peso lordo complessivo o al confezionamento frazionato ovvero ad altre circostanze dell'azione, da cui risulti che le sostanze sono destinate ad un uso esclusivamente personale;
b) che i medicinali contenenti sostanze stupefacenti o psicotrope elencate nella tabella dei medicinali, sezioni A, B, C e D, non eccedano il quantitativo prescritto”»;
al comma 27:
alla lettera a), capoverso 1, le parole: «servizio pubblico per le tossicodipendenze» sono sostituite dalle seguenti: «servizio pubblico per le dipendenze»;
alla lettera c), capoverso 4, le parole: «servizio pubblico per le tossicodipendenze» sono sostituite dalle seguenti: «servizio pubblico per le dipendenze»;
alla lettera d), capoverso 7, primo periodo, le parole: «servizio pubblico per le tossicodipendenze» sono sostituite dalle seguenti: «servizio pubblico per le dipendenze» e le parole: «, salvo l'obbligo di segnalare all'autorità competente tutte le violazioni commesse dalla persona sottoposta al programma terapeutico alternativo a sanzioni amministrative o ad esecuzione di pene detentive,» sono soppresse;
al comma 28, lettera a), capoverso 1:
al primo periodo, le parole: «Il servizio pubblico per le tossicodipendenze» sono sostituite dalle seguenti: «Il servizio pubblico per le dipendenze»;
il terzo periodo è sostituito dal seguente: «Il servizio pubblico per le dipendenze verifica l'efficacia del trattamento e la risposta del paziente al programma»;
dopo il comma 28 è inserito il seguente:
«28-bis. Al comma 1 dell'articolo 123 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, e successive modificazioni, le parole: “alle tabelle I e II, sezioni A, B e C,” sono sostituite dalle seguenti: “alla tabella I e alla tabella dei medicinali”»;
al comma 29, capoverso 8, le parole: «, purché i dosaggi somministrati e la durata del trattamento abbiano l'esclusiva finalità clinico-terapeutica di avviare gli utenti a successivi programmi riabilitativi» sono soppresse.
All'articolo 2:
al comma 1, la parola: «continuano» è sostituita dalla seguente: «riprendono»;
dopo il comma 1 è aggiunto il seguente:
«1-bis. Nei decreti applicativi del testo unico di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, adottati dalla data di entrata in vigore della legge 21 febbraio 2006, n. 49, fino alla data di pubblicazione della sentenza della Corte costituzionale n. 32 del 12 febbraio 2014, ogni richiamo alla tabella II è da intendersi riferito alla tabella dei medicinali, di cui all'allegato A al presente decreto».
Alla rubrica del capo II, le parole: «meno onerosi da parte del Servizio sanitario nazionale» sono soppresse.
L'articolo 3 è sostituito dal seguente:
«Art. 3. – (Disposizioni in materia di impiego di medicinali). – 1. All'articolo 48, comma 19, lettera b), numero 3), del decreto-legge 30 settembre 2003, n. 269, convertito, con modificazioni, dalla legge 24 novembre 2003, n. 326, sono aggiunte, in fine, le seguenti parole: “, e, anche su richiesta delle regioni e delle province autonome di Trento e di Bolzano o delle società scientifiche nazionali del settore clinico di specifico interesse, sentito il Consiglio superiore di sanità, alla sperimentazione clinica di medicinali per un impiego non compreso nell'autorizzazione all'immissione in commercio”.
2. Dopo il comma 4 dell'articolo 1 del decreto-legge 21 ottobre 1996, n. 536, convertito dalla legge 23 dicembre 1996, n. 648, è inserito il seguente:
“4-bis. Anche se sussista altra alternativa terapeutica nell'ambito dei medicinali autorizzati, previa valutazione dell'Agenzia italiana del farmaco (AIFA), sono inseriti nell'elenco di cui al comma 4, con conseguente erogazione a carico del Servizio sanitario nazionale, i medicinali che possono essere utilizzati per una indicazione terapeutica diversa da quella autorizzata, purché tale indicazione sia nota e conforme a ricerche condotte nell'ambito della comunità medico-scientifica nazionale e internazionale, secondo parametri di economicità e appropriatezza. In tal caso l'AIFA attiva idonei strumenti di monitoraggio a tutela della sicurezza dei pazienti e assume tempestivamente le necessarie determinazioni”».
La tabella I è sostituita dalla seguente:
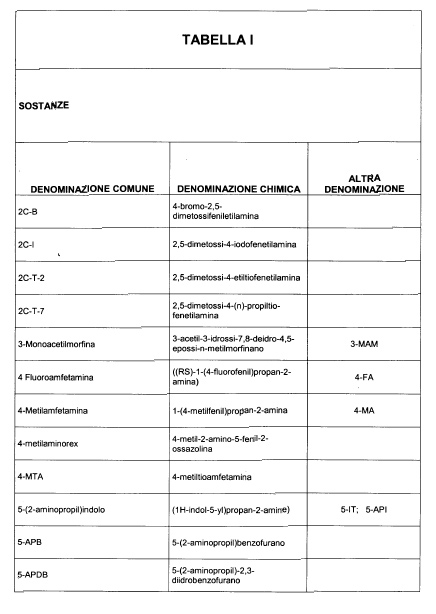
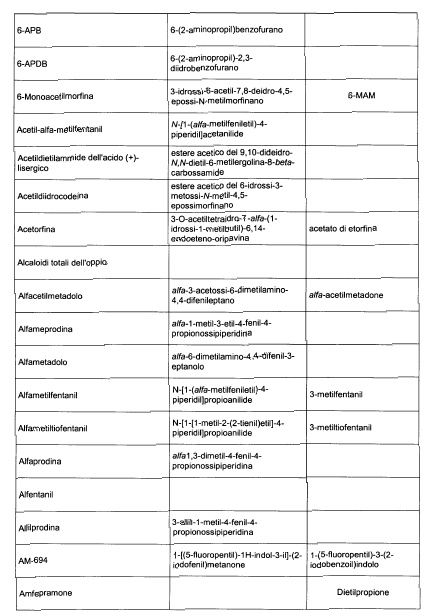
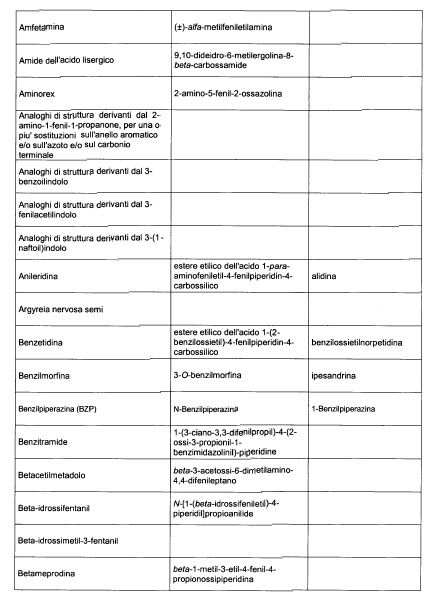
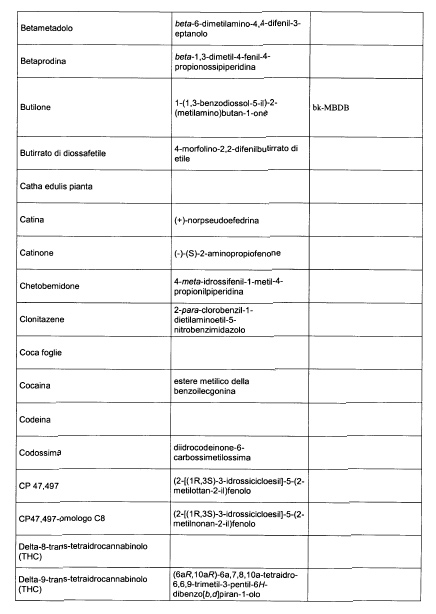
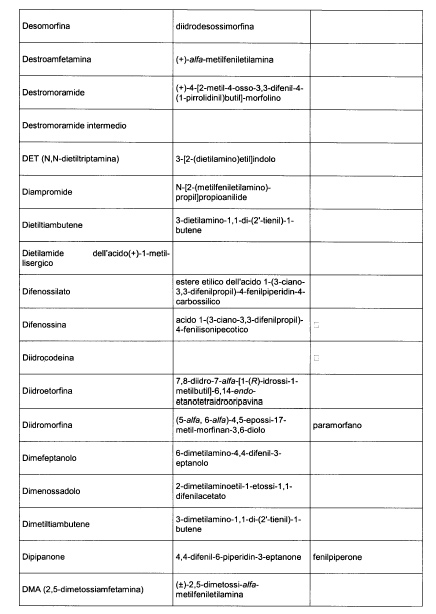
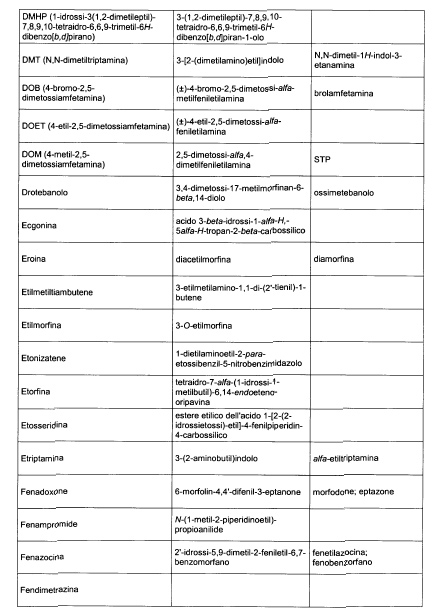

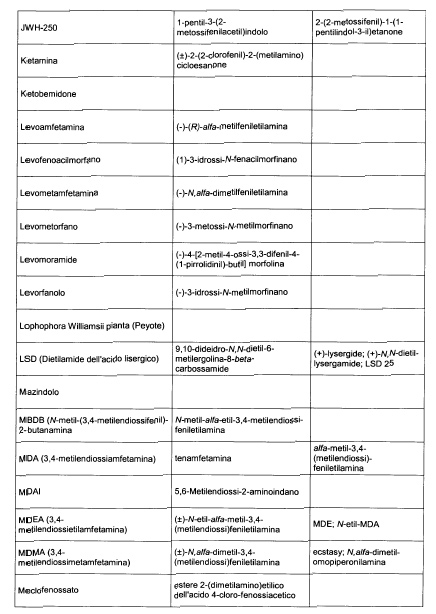
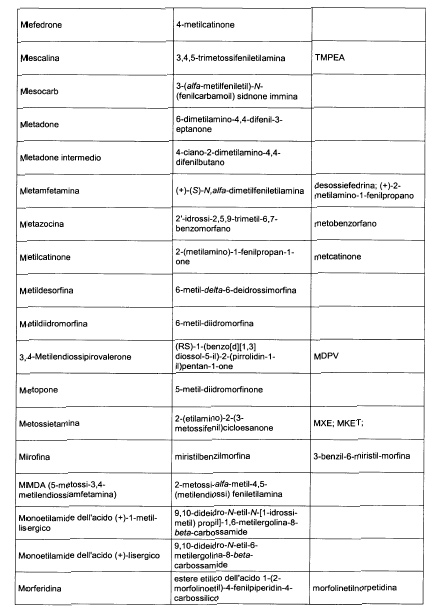
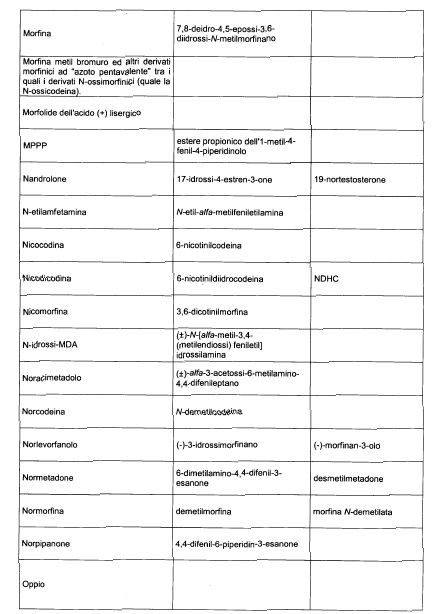
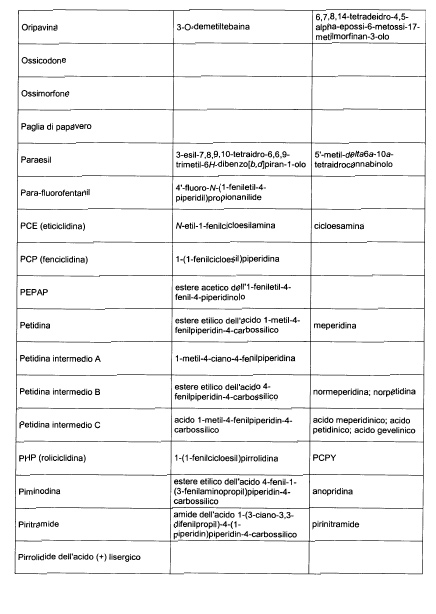
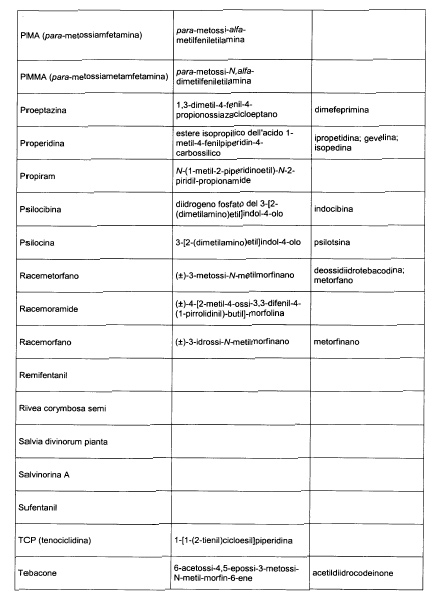
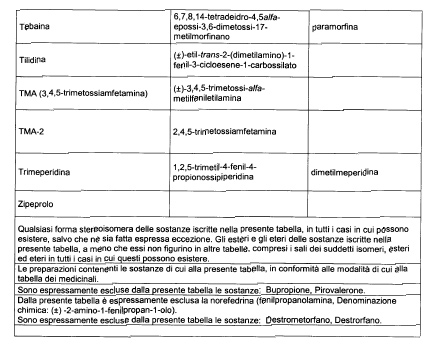
Alla tabella II, la parola: «Indica», ovunque ricorre, è soppressa.
Alla tabella IV:
la voce: «Amfepramone/Dietilpropione» è sostituita dalla seguente: «Amineptina»;
le voci: «Fendimetrazina», «Fentermina» e «Mazindolo» sono soppresse;
dopo la voce: «Nordazepam/Desmetildiazepam» è inserita la seguente: «Ossazepam».
Al titolo del decreto-legge, le parole: «meno onerosi da parte del Servizio sanitario nazionale» sono soppresse.
A.C. 2215-A/R – Proposte emendative
PROPOSTE EMENDATIVE RIFERITE AGLI ARTICOLI DEL DECRETO-LEGGE
ART. 1.
(Modificazioni al testo unico di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309).
Sostituirlo con il seguente:
Art. 1. – (Modificazioni al testo unico di cui al decreto del Presidente della Repubblica n. 309 del 1990). – 1. All'articolo 2 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, alla lettera e), il numero 2) è sostituito dal seguente:
«2) il completamento e l'aggiornamento delle tabelle di cui all'articolo 13, sentiti il Consiglio superiore di sanità e la Presidenza del Consiglio dei Ministri-Dipartimento nazionale per le politiche antidroga»;
2. All'articolo 13 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
«1. Le sostanze stupefacenti o psicotrope sottoposte alla vigilanza ed al controllo del Ministero della salute sono raggruppate, in conformità ai criteri di cui all'articolo 14, in due tabelle, allegate al presente testo unico. Il Ministero della sedute stabilisce con proprio decreto il completamento e l'aggiornamento delle tabelle con le modalità di cui all'articolo 2, comma 1, lettera e), numero 2)»;
b) il comma 3 è abrogato;
c) il comma 5 è sostituito dal seguente:
«5. Il Ministero della salute, sentiti il Consiglio superiore di sanità e la Presidenza del Consiglio dei Ministri – Dipartimento nazionale per le politiche antidroga, ed in accordo con le convenzioni internazionali in materia di sostanze stupefacenti o psicotrope, dispone con apposito decreto l'esclusione da una o più misure di controllo di quei medicinali e dispositivi diagnostici che per la loro composizione qualitativa e quantitativa non possono trovare un uso diverso da quello cui sono destinati».
3. L'articolo 14 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 14 – (Criteri per la formazione delle tabelle). – 1. La inclusione delle sostanze stupefacenti o psicotrope nelle tabelle di cui all'articolo 13 è effettuata in base ai seguenti criteri:
a) nella tabella I sono indicati:
1) l'oppio e i materiali da cui possono essere ottenute le sostanze oppiacee naturali, estraibili dal papavero sonnifero; gli alcaloidi ad azione narcotico-analgesica da esso estraibili; le sostanze ottenute per trasformazione chimica di quelle prima indicate; le sostanze ottenibili per sintesi che siano riconducibili, per struttura chimica o per effetti, a quelle oppiacee precedentemente indicate; eventuali intermedi per la loro sintesi;
2) le foglie di coca e gli alcaloidi ad azione eccitante sul sistema nervoso centrale da queste estraibili; le sostanze ad azione analoga ottenute per trasformazione chimica degli alcaloidi sopra indicati oppure per sintesi;
3) le sostanze di tipo amfetaminico ad azione eccitante sul sistema nervoso centrale;
4) ogni altra sostanza che produca effetti sul sistema nervoso centrale ed abbia capacità di determinare dipendenza fisica o psichica dello stesso ordine o di ordine superiore a quelle precedentemente indicate;
5) gli indolici, siano essi derivati triptaminici che lisergici, e i derivati feniletilamminici, che abbiano effetti allucinogeni o che possano provocare distorsioni sensoriali;
6) la cannabis indica, i prodotti da essa ottenuti; i tetraidrocannabinoli, i loro analoghi naturali, le sostanze ottenute per sintesi o semisintesi che siano ad essi riconducibili per struttura chimica o per effetto farmaco-tossicologico;
7) ogni altra pianta i cui principi attivi possono provocare allucinazioni o gravi distorsioni sensoriali e tutte le sostanze ottenute per estrazione o per sintesi chimica che provocano la stessa tipologia di effetti a carico del sistema nervoso centrale;
b) nella sezione A della tabella II sono indicati:
1) i medicinali contenenti le sostanze analgesiche oppiacee naturali, di semisintesi e di sintesi;
2) i medicinali di cui all'allegato III-bis al presente testo unico;
3) i medicinali contenenti sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di grave dipendenza fisica o psichica;
4) i barbiturici che hanno notevole capacità di indurre dipendenza fisica o psichica o entrambe, nonché altre sostanze ad effetto ipnotico-sedativo ad essi assimilabili ed i medicinali che li contengono;
c) nella sezione B della tabella II sono indicati:
1) i medicinali che contengono sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica di intensità e gravità minori di quelli prodotti dai medicinali elencati nella sezione A;
2) i barbiturici ad azione antiepilettica e i barbiturici con breve durata d'azione;
3) le benzodiazepine, i derivati pirazolopirimidinici ed i loro analoghi ad azione ansiolitica o psicostimolante che possono dar luogo al pericolo di abuso e generare farmacodipendenza;
d) nella sezione C della tabella II sono indicati:
1) le composizioni medicinali contenenti le sostanze elencate nella tabella II, sezione B, da sole o in associazione con altri principi attivi, per i quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica;
e) nella sezione D della tabella II sono indicati:
1) le composizioni medicinali contenenti le sostanze elencate nella tabella II, sezioni A o B, da sole o in associazione con altri principi attivi quando per la loro composizione qualitativa e quantitativa e per le modalità del loro uso, presentano rischi di abuso o farmacodipendenza di grado inferiore a quello delle composizioni medicinali comprese nella tabella II, sezioni A e C, e pertanto non sono assoggettate alla disciplina delle sostanze che entrano a far parte della loro composizione;
2) le composizioni medicinali ad uso parenterale a base di benzodiazepine;
3) le composizioni medicinali per uso diverso da quello iniettabile, le quali, in associazione con altri principi attivi non stupefacenti contengono alcaloidi totali dell'oppio con equivalente ponderale in morfina non superiore allo 0,05 per cento in peso espresso come base anidra; le suddette composizioni medicinali devono essere tali da impedire praticamente il recupero dello stupefacente con facili ed estemporanei procedimenti estrattivi;
f) nella sezione E della tabella II sono indicati:
1) le composizioni medicinali contenenti le sostanze elencate nella tabella II, sezioni A o B, da sole o in associazione con altri principi attivi, quando per la loro composizione qualitativa e quantitativa o per le modalità del loro uso, possono dar luogo a pericolo di abuso o generare farmacodipendenza di grado inferiore a quello delle composizioni medicinali elencate nella tabella II, sezioni A, C o D.
2. Nelle tabelle I e II sono compresi, ai fini della applicazione del presente testo unico, tutti gli isomeri, gli esteri, gli eteri, ed i sali anche relativi agli isomeri, esteri ed eteri, nonché gli stereoisomeri nei casi in cui possono essere prodotti, relativi alle sostanze ed ai preparati inclusi nelle tabelle, salvo sia fatta espressa eccezione.
3. Le sostanze incluse nelle tabelle sono indicate con la denominazione comune internazionale, il nome chimico, la denominazione comune italiana o l'acronimo, se esiste. È, tuttavia, ritenuto sufficiente, ai fini della applicazione del presente testo unico, che nelle tabelle la sostanza sia indicata con almeno una delle denominazioni sopra indicate, purché idonea ad identificarla.
4. Le sostanze e le piante di cui al comma 1, lettera a), sono soggette alla disciplina del presente testo unico anche quando si presentano sotto ogni forma di prodotto, miscuglio o miscela».
4. All'articolo 26 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Salvo quanto stabilito nel comma 2, è vietata nel territorio dello Stato la coltivazione delle piante comprese nella tabella I di cui all'articolo 14».
5. All'articolo 31 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 1, le parole: «I, II, III, IV e V» sono sostituite dalle seguenti: «le II, sezioni A e B».
6. All'articolo 34 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente: «1. Presso ciascun ente o impresa, autorizzati alla fabbricazione di sostanze stupefacenti o psicotrope, comprese nelle tabelle le II, sezione A, di cui all'articolo 14, devono essere dislocati uno o più militari della Guardia di finanza per il controllo dell'entrata e dell'uscita delle sostanze stupefacenti o psicotrope, nonché per la sorveglianza a carattere continuativo durante i cicli di lavorazione».
7. All'articolo 35 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 1, le parole: «I, II, III, IV e VI» sono sostituite dalle seguenti: «le II, sezioni A e B».
8. All'articolo 36 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «I, II, III, IV e V» sono sostituite dalle seguenti: «I e II»;
b) al comma 3, le parole: «delle preparazioni ottenute» sono sostituite dalle seguenti: «dei prodotti ottenuti».
9. All'articolo 38 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
«1. La vendita o cessione, a qualsiasi titolo, anche gratuito, delle sostanze e dei medicinali compresi nelle tabelle le II di cui all'articolo 14 deve essere fatta alle persone autorizzate a norma del presente testo unico in base a richiesta scritta da staccarsi da apposito bollettario “buoni acquisto” conforme al modello predisposto e distribuito dal Ministero della salute. La richiesta scritta non è necessaria per la vendita o cessione a qualsiasi titolo ai titolari o direttori di farmacie aperte al pubblico o ospedaliere per quanto attiene ai medicinali compresi nella tabella II, sezioni D ed E, acquistati presso le imprese autorizzate al commercio all'ingrosso. I titolari o i direttori di farmacie aperte al pubblico o ospedaliere possono utilizzare il bollettario “buoni acquisto” anche per richiedere, a titolo gratuito, i medicinali compresi nella tabella II, sezioni A, B e C, ad altre farmacie aperte al pubblico o ospedaliere, qualora si configuri il carattere di urgenza terapeutica»;
b) dopo il comma 1 è inserito il seguente:
«1-bis. Il Ministero della salute dispone, con proprio decreto, il modello di bollettario “buoni acquisto” adatto alle richieste cumulative».
10. Il comma 1 dell'articolo 40 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«1. Il Ministero della salute, nel rispetto delle normative comunitarie, al momento dell'autorizzazione all'immissione in commercio, determina, in rapporto alla loro composizione, indicazione terapeutica e posologia, le confezioni dei medicinali contenenti sostanze stupefacenti o psicotrope che possono essere messe in commercio ed individua, in applicazione dei criteri di cui all'articolo 14, la sezione della tabella II in cui collocare il medicinale stesso».
11. All'articolo 41 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, lettera d), le parole: «previste dall'articolo 14» sono sostituite dalle seguenti: «, sezione A, di cui all'articolo 14»;
b) al comma 1-bis, la parola: «farmaci» è sostituita dalla seguente: «medicinali».
12. All'articolo 42 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) la rubrica è sostituita dalla seguente: «Acquisto di medicinali a base di sostanze stupefacenti e di sostanze psicotrope da parte di medici chirurghi»;
b) il comma 1 è sostituito dal seguente:
«1. I medici chirurghi ed i medici veterinari, i direttori sanitari o responsabili di ospedali, case di cura in genere, prive dell'unità operativa di farmacia, e titolari di gabinetto per l'esercizio delle professioni sanitarie qualora, per le normali esigenze terapeutiche, si determini la necessità di approvvigionarsi di medicinali a base di sostanze stupefacenti o psicotrope compresi nella tabella II, sezioni A, B e C, di cui all'articolo 14, devono farne richiesta scritta in triplice copia alla farmacia o al grossista di medicinali. La prima delle predette copie rimane per documentazione al richiedente; le altre due devono essere rimesse alla farmacia o alla ditta all'ingrosso; queste ultime ne trattengono una per il proprio discarico e trasmettono l'altra all'azienda sanitaria locale a cui fanno riferimento»;
c) al comma 2, le parole: «delle predette preparazioni» sono sostituite dalle seguenti: «dei predetti medicinali» e le parole: «lire duecentomila a lire un milione» sono sostituite dalle seguenti: «euro 100 ad euro 500»;
d) al comma 3, le parole: «delle preparazioni acquistate» sono sostituite dalle seguenti: «dei medicinali acquistati» e le parole: «delle preparazioni stesse» sono sostituite dalle seguenti: «dei medicinali stessi».
13. L'articolo 43 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 43 – (Obblighi dei medici chirurghi e dei medici veterinari). – 1. I medici chirurghi e i medici veterinari prescrivono i medicinali compresi nella tabella II, sezione A, di cui all'articolo 14, su apposito ricettario approvato con decreto del Ministero della salute.
2. La prescrizione dei medicinali indicati nella tabella II, sezione A, di cui all'articolo 14 può comprendere un solo medicinale per una cura di durata non superiore a trenta giorni, ad eccezione della prescrizione dei medicinali di cui all'allegato III-bis per i quali la ricetta può comprendere fino a due medicinali diversi tra loro o uno stesso medicinale con due dosaggi differenti per una cura di durata non superiore a trenta giorni.
3. Nella ricetta devono essere indicati:
a) cognome e nome dell'assistito ovvero del proprietario dell'animale ammalato;
b) la dose prescritta, la posologia ed il modo di somministrazione;
c) l'indirizzo e il numero telefonico professionali del medico chirurgo o del medico veterinario da cui la ricetta è rilasciata;
d) la data e la firma del medico chirurgo o del medico veterinario da cui la ricetta è rilasciata;
e) il timbro personale del medico chirurgo o del medico veterinario da cui la ricetta è rilasciata.
4. Le ricette di cui al comma 1 sono compilate in duplice copia a ricalco per i medicinali non forniti dal Servizio sanitario nazionale, ed in triplice copia a ricalco per i medicinali forniti dal Servizio sanitario nazionale. Una copia della ricetta è comunque conservata dall'assistito o dal proprietario dell'animale ammalato. Il Ministero della salute stabilisce con proprio decreto la forma ed il contenuto del ricettario di cui al comma 1.
5. La prescrizione dei medicinali compresi nella tabella II, sezione A, di cui all'articolo 14, qualora utilizzati per il trattamento di disassuefazione dagli stati di tossicodipendenza da oppiacei o di alcooldipendenza, è effettuata utilizzando il ricettario di cui al comma 1 nel rispetto del piano terapeutico predisposto da una struttura sanitaria pubblica o da una struttura privata autorizzata ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi di cui al comma 2, lettera d), del medesimo articolo. La persona alla quale sono consegnati in affidamento i medicinali di cui al presente comma è tenuta ad esibire a richiesta la prescrizione medica o il piano terapeutico in suo possesso.
6. I medici chirurghi e i medici veterinari sono autorizzati ad approvvigionarsi attraverso autoricettazione, a trasportare e a detenere i medicinali compresi nell'allegato III-bis per uso professionale urgente, utilizzando il ricettario di cui al comma 1. Una copia della ricetta è conservata dal medico chirurgo o dal medico veterinario che tiene un registro delle prestazioni effettuate, annotandovi le movimentazioni, in entrata ed uscita, dei medicinali di cui si è approvvigionato e che successivamente ha somministrato. Il registro delle prestazioni non è di modello ufficiale e deve essere conservato per due anni a far data dall'ultima registrazione effettuata; le copie delle autoricettazioni sono conservate, come giustificativo dell'entrata, per lo stesso periodo del registro.
7. Il personale che opera nei distretti sanitari di base o nei servizi territoriali o negli ospedali pubblici o accreditati delle aziende sanitarie locali è autorizzato a consegnare al domicilio di pazienti affetti da dolore severo in corso di patologia neoplastica o degenerativa, ad esclusione del trattamento domiciliare degli stati di tossicodipendenza da oppiacei, le quantità terapeutiche dei medicinali compresi nell'allegato III-bis accompagnate dalla certificazione medica che ne prescrive la posologia e l'utilizzazione nell'assistenza domiciliare.
8. Gli infermieri professionali che effettuano servizi di assistenza domiciliare nell'ambito dei distretti sanitari di base o nei servizi territoriali delle aziende sanitarie locali e i familiari dei pazienti, opportunamente identificati dal medico o dal farmacista che ivi effettuano servizio, sono autorizzati a trasportare le quantità terapeutiche dei medicinali compresi nell'allegato III-bis accompagnate dalla certificazione medica che ne prescrive la posologia e l'utilizzazione a domicilio di pazienti affetti da dolore severo in corso di patologia neoplastica o degenerativa, ad esclusione del trattamento domiciliare degli stati di tossicodipendenza da oppiacei.
9. La prescrizione dei medicinali compresi nella tabella II, sezioni B, C e D, di cui all'articolo 14 è effettuata con ricetta da rinnovarsi volta per volta e da trattenersi da parte del farmacista.
10. La prescrizione dei medicinali compresi nella tabella II, sezione E, di cui all'articolo 14 è effettuata con ricetta medica».
14. L'articolo 45 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 45 – (Dispensazione dei medicinali). – 1. La dispensazione dei medicinali compresi nella tabella II, sezione A, di cui all'articolo 14 è effettuata dal farmacista che si accerta dell'identità dell'acquirente e prende nota degli estremi di un documento di riconoscimento da trascrivere sulla ricetta.
2. Il farmacista dispensa i medicinali di cui al comma 1 dietro presentazione di prescrizione medica compilata sulle ricette previste dal comma 1 dell'articolo 43 nella quantità e nella forma farmaceutica prescritta.
3. Il farmacista ha l'obbligo di accertare che la ricetta sia stata redatta secondo le disposizioni stabilite nell'articolo 43, di annotarvi la data di spedizione e di apporvi il timbro della farmacia e di conservarla tenendone conto ai fini del discarico dei medicinali sul registro di entrata e uscita di cui al comma 1 dell'articolo 60.
4. La dispensazione dei medicinali di cui alla tabella II, sezioni B e C, è effettuata dal farmacista dietro presentazione di ricetta medica da rinnovarsi volta per volta. Il farmacista appone sulla ricetta la data di spedizione e il timbro della farmacia e la conserva tenendone conto ai fini del discarico dei medicinali sul registro di entrata e di uscita di cui all'articolo 60, comma 1.
5. Il farmacista conserva per due anni, a partire dal giorno dell'ultima registrazione nel registro di cui all'articolo 60, comma 1, le ricette che prescrivono medicinali compresi nella tabella II, sezioni A, B e C. Nel caso di fornitura di medicinali a carico del Servizio sanitario nazionale, il farmacista è tenuto a conservare una copia della ricetta originale o fotocopia della ricetta originale, recante la data di spedizione.
6. La dispensazione dei medicinali di cui alla tabella II, sezione D, è effettuata dal farmacista dietro presentazione di ricetta medica da rinnovarsi volta per volta.
7. La dispensazione dei medicinali di cui alici tabella II, sezione E, è effettuata dal farmacista dietro presentazione di ricetta medica.
8. Decorsi trenta giorni dalla data del rilascio, la prescrizione medica non può essere più spedita.
9. Salvo che il fatto costituisca reato, il contravventore alle disposizioni del presente articolo è soggetto alla sanzione amministrativa pecuniaria del pagamento di una somma da euro 100 ad euro 600.
10. Il Ministro della salute provvede a stabilire, con proprio decreto, tenuto conto di quanto previsto dal decreto ministeriale 15 luglio 2004 in materia di tracciabilità di medicinali, la forma ed il contenuto dei moduli idonei al controllo del movimento dei medicinali a base di sostanze stupefacenti o psicotrope tra le farmacie interne degli ospedali e singoli reparti».
15. All'articolo 46 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «delle preparazioni indicate nelle tabelle I, II, III, IV e V previste» sono sostituite dalle seguenti: «dei medicinali compresi nella tabella II, sezioni A, C e D, prevista»;
b) al comma 4, le parole: «delle preparazioni» sono sostituite dalle seguenti: «dei medicinali».
16. All'articolo 47 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «delle preparazioni indicate nelle tabelle I, II, III, IV e V previste» sono sostituite dalle seguenti: «dei medicinali compresi nella tabella II, sezioni A, C e D, prevista»;
b) al comma 4, le parole: «delle preparazioni» sono sostituite dalle seguenti: «dei medicinali».
17. All'articolo 54 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «I, II, III, IV e V» sono sostituite dalle seguenti: «I e II, sezioni A e B,»;
b) al comma 2, le parole: «I, II, e III» sono sostituite dalle seguenti: «I e II, sezione A,».
18. L'articolo 60 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 60 – (Registro di entrata e uscita). – 1. Ogni acquisto o cessione, anche a titolo gratuito, di sostanze e di medicinali di cui alle tabelle previste dall'articolo 14, è iscritto in un registro speciale nel quale, senza alcuna lacuna, abrasione o aggiunta, in ordine cronologico, secondo una progressione numerica unica per ogni sostanza o medicinale, è tenuto in evidenza il movimento di entrata e di uscita delle stesse sostanze o medicinali. Tale registro è numerato e firmato in ogni pagina dal responsabile dell'azienda unità sanitaria locale o da un suo delegato che riporta nella prima pagina gli estremi della autorizzazione ministeriale e dichiara nell'ultima il numero delle pagine di cui il registro è costituito. Il registro è conservato da parte degli enti e delle imprese autorizzati alla fabbricazione, per la durata di dieci anni dal giorno dell'ultima registrazione. Detto termine è ridotto a cinque anni per le officine autorizzate all'impiego e per le imprese autorizzate al commercio all'ingrosso.
2. I responsabili delle farmacie aperte al pubblico e delle farmacie ospedaliere riportano sul registro il movimento dei medicinali di cui alla tabella II, sezioni A, B e C secondo le modalità indicate al comma precedente.
3. Le unità operative delle strutture sanitarie pubbliche e private, nonché le unità operative dei servizi territoriali delle aziende sanitarie locali sono dotate di registro di carico e scarico dei medicinali di cui alla tabella II, sezioni A, B e C, prevista dall'articolo 14.
4. I registri di cui ai commi 1 e 3 sono conformi ai modelli predisposti dal Ministero della salute.
5. In alternativa ai registri di cui ai commi 1 e 3, il Ministero della salute stabilisce con proprio decreto le modalità di registrazione su supporto informatico della movimentazione delle sostanze e dei medicinali di cui alle tabelle previste dall'articolo 14.
6. Il registro di cui al comma 3 è vidimato dal direttore sanitario, o da un suo delegato, che provvede alla sua distribuzione. Il registro è conservato, in ciascuna unità operativa, dal responsabile dell'assistenza infermieristica per due anni dalla data dell'ultima registrazione.
7. Il dirigente medico preposto all'unità operativa è responsabile della effettiva corrispondenza tra la giacenza contabile e quella reale dei medicinali di cui alla tabella II, sezioni A, B e C, prevista dall'articolo 14.
8. Il direttore responsabile del servizio farmaceutico compie periodiche ispezioni per accertare la corretta tenuta dei registri di reparto di cui al comma 3 e redige apposito verbale da trasmettere alla direzione sanitaria».
19. All'articolo 61 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Nel registro di cui all'articolo 60, comma 1, tenuto da enti e imprese autorizzati alla fabbricazione di sostanze stupefacenti o psicotrope nonché dei medicinali, compresi nelle tabelle di cui all'articolo 14, è annotata ciascuna operazione di entrata e di uscita o di passaggio in lavorazione».
20. All'articolo 62 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Il registro di cui all'articolo 60, comma 1, tenuto dagli enti e imprese autorizzati all'impiego ed al commercio di sostanze stupefacenti o psicotrope nonché dei medicinali di cui alle tabelle previste dall'articolo 14 ed il registro delle farmacie per quanto concerne i medicinali di cui alla tabella II, sezioni A e C, dell'articolo 14, sono chiusi al 31 dicembre di ogni anno. La chiusura si compie mediante scritturazione riassuntiva di tutti i dati comprovanti i totali delle qualità e quantità dei prodotti avuti in carico e delle quantità e qualità dei prodotti impiegati o commercializzati durante l'anno, con l'indicazione di ogni eventuale differenza o residuo».
21. All'articolo 63 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Gli enti o le imprese autorizzati alla fabbricazione di sostanze stupefacenti o psicotrope nonché dei medicinali compresi nelle tabelle di cui all'articolo 14 tengono anche un registro di lavorazione, numerato e firmato in ogni pagina da un funzionario del Ministero della sedute all'uopo delegato, nel quale sono iscritte le quantità di materie prime poste in lavorazione, con indicazione della loro esatta denominazione e della data di entrata nel reparto di lavorazione, nonché i prodotti ottenuti da ciascuna lavorazione».
22. Il comma 1 dell'articolo 65 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«1. Gli enti e le imprese autorizzati alla produzione, alla fabbricazione e all'impiego di sostanze stupefacenti o psicotrope nonché dei medicinali, compresi nelle tabelle di cui all'articolo 14, trasmettono al Ministero della salute, alla Direzione centrale per i servizi antidroga e alla competente unità sanitaria locale annualmente, non oltre il 31 gennaio di ciascun anno, i dati riassuntivi dell'anno precedente e precisamente:
a) i risultati di chiusura del registro di carico e scarico;
b) la quantità e qualità delle sostanze utilizzate per la produzione di medicinali preparati nel corso dell'anno;
c) la quantità e la qualità dei medicinali venduti nel corso dell'anno;
d) la quantità e la qualità delle giacenze esistenti al 31 dicembre».
23. All'articolo 66 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Gli enti e le imprese autorizzati ai sensi dell'articolo 17 che abbiano effettuato importazioni o esportazioni di sostanze stupefacenti o psicotrope nonché di medicinali compresi nelle tabelle di cui all'articolo 14, trasmettono al Ministero della salute, entro quindici giorni dalla fine di ogni trimestre, i dati relativi ai permessi di importazione o di esportazione utilizzati nel corso del trimestre precedente. Gli enti e le imprese autorizzati alla fabbricazione trasmettono, altresì, un rapporto sulla natura e quantità delle materie prime ricevute e di quelle utilizzate per la lavorazione degli stupefacenti o sostanze psicotrope nonché dei medicinali ricavati, e di quelli venduti nel corso del trimestre precedente. In tale rapporto, per l'oppio grezzo, nonché per le foglie e pasta di coca è indicato il titolo in principi attivi ad azione stupefacente».
24. Gli articoli 69 e 71 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono abrogati.
25. All'articolo 73 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) la rubrica è sostituita dalla seguente: «Produzione, traffico e detenzione illeciti di sostanze stupefacenti o psicotrope»;
b) il comma 1 è sostituito dal seguente:
«1. Chiunque, senza l'autorizzazione di cui all'articolo 17, coltiva, produce, fabbrica, estrae, raffina, vende, offre o mette in vendita, cede, distribuisce, commerci, trasporta, procura ad altri, invia, passa o spedisce in transito, consegna per qualunque scopo sostanze stupefacenti o psicotrope di cui alla tabella I prevista dall'articolo 14, è punito con la reclusione da sei a venti anni e con la multa da euro 26.000 a euro 260.000»;
c) dopo il comma 1 è inserito il seguente:
«1-bis. Con le medesime pene di cui al comma 1 è punito chiunque, senza l'autorizzazione di cui all'articolo 17, importa, esporta, acquista, riceve a qualsiasi titolo o comunque illecitamente detiene:
a) sostanze stupefacenti o psicotrope che per quantità, in particolare se superiore ai limiti massimi indicati con decreto del Ministro della salute emanato di concerto con il Ministro della giustizia sentita la Presidenza del Consiglio dei Ministri – Dipartimento nazionale per le politiche antidroga, ovvero per modalità di presentazione, avuto riguardo al peso lordo complessivo o al confezionamento frazionato, ovvero per altre circostanze dell'azione, appaiono destinate ad un uso non esclusivamente personale;
b) medicinali contenenti sostanze stupefacenti o psicotrope elencate nella tabella II, sezione A, che eccedono il quantitativo prescritto. In questa ultima ipotesi, le pene suddette sono diminuite da un terzo alla metà»;
d) il comma 2 è sostituito dal seguente:
«2. Chiunque, essendo munito dell'autorizzazione di cui all'articolo 17, illecitamente cede, mette o procura che altri metta in commercio le sostanze o le preparazioni indicate nelle tabelle le II di cui all'articolo 14, è punito con la reclusione da sei a ventidue anni e con la multa da euro 26.000 a euro 300.000»;
e) dopo il comma 2 è inserito il seguente:
«2-bis. Le pene di cui al comma 2 si applicano anche nel caso di illecita produzione o commercializzazione delle sostanze chimiche di base e dei precursori di cui alle categorie 1, 2 e 3 dell'allegato I al presente testo unico, utilizzabili nella produzione clandestina delle sostanze stupefacenti o psicotrope previste nelle tabelle di cui all'articolo 14»;
f) i commi 3, 4 e 5 sono sostituiti dai seguenti:
«3. Le stesse pene si applicano a chiunque coltiva, produce o fabbrica sostanze stupefacenti o psicotrope diverse da quelle stabilite nel decreto di autorizzazione.
4. Quando le condotte di cui al comma 1 riguardano i medicinali ricompresi nella tabella II, sezioni A, B e C, di cui all'articolo 14 e non ricorrono le condizioni di cui all'articolo 17, si applicano le pene ivi stabilite, diminuite da un terzo alla metà.
5. Quando, per i mezzi, per la modalità o le circostanze dell'azione ovvero per la qualità e quantità delle sostanze, i fatti previsti dal presente articolo sono di lieve entità, si applicano le pene della reclusione da uno a sei anni e della multa da euro 3.000 a euro 26.000»;
g) dopo il comma 5 è inserito il seguente:
«5-bis. Nell'ipotesi di cui al comma 5, limitatamente ai reati di cui al presente articolo commessi da persona tossicodipendente o da assuntore di sostanze stupefacenti o psicotrope, il giudice, con la sentenza di condanna o di applicazione della pena su richiesta delle parti a norma dell'articolo 444 del codice di procedura penale, su richiesta dell'imputato e sentito il pubblico ministero, qualora non debba concedersi il beneficio della sospensione condizionale della pena, può applicare, anziché le pene detentive e pecuniarie, quella del lavoro di pubblica utilità di cui all'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, secondo le modalità ivi previste. Con la sentenza il giudice incarica l'Ufficio locale di esecuzione penale esterna di verificare l'effettivo svolgimento del lavoro di pubblica utilità. L'Ufficio riferisce periodicamente al giudice. In deroga a quanto disposto dall'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, il lavoro di pubblica utilità ha una durata corrispondente a quella della sanzione detentiva irrogata. Esso può essere disposto anche nelle strutture private autorizzate ai sensi dell'articolo 116, previo consenso delle stesse. In caso di violazione degli obblighi connessi allo svolgimento del lavoro di pubblica utilità, in deroga a quanto previsto dall'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, su richiesta del pubblico ministero o d'ufficio, il giudice che procede, o quello dell'esecuzione, con le formalità di cui all'articolo 666 del codice di procedura penale, tenuto conto dell'entità dei motivi e delle circostanze della violazione, dispone la revoca della pena con conseguente ripristino di quella sostituita. Avverso tale provvedimento di revoca è ammesso ricorso per Cassazione, che non ha effetto sospensivo. Il lavoro di pubblica utilità può sostituire la pena per non più di due volte».
26. All'articolo 79 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
«1. Chiunque adibisce o consente che sia adibito un locale pubblico o un circolo privato di qualsiasi specie a luogo di convegno di persone che ivi si danno all'uso di sostanze stupefacenti o psicotrope è punito, per questo solo fatto, con la reclusione da tre a dieci anni e con la multa da euro 3.000 ad euro 10.000 se l'uso riguarda le sostanze e i medicinali compresi nelle tabelle le II, sezione A, previste dall'articolo 14, o con la reclusione da uno a quattro anni e con la multa da euro 3.000 ad euro 26.000 se l'uso riguarda i medicinali compresi nella tabella II, sezione B, prevista dallo stesso articolo 14».
27. All'articolo 82 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 4, le parole: «le sostanze di cui alle tabelle II e IV previste» sono sostituite dalle seguenti: «i medicinali di cui alla tabella II, sezione B, prevista».
28. All'articolo 114 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 2 è sostituito dal seguente:
«2. Il perseguimento degli obiettivi previsti dal comma 1 può essere affidato dai comuni e dalle comunità montane o dalle loro associazioni alle competenti aziende unità sanitarie locali o alle strutture private autorizzate ai sensi dell'articolo 116».
29. All'articolo 115 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 1 la parola: «ausiliari» è soppressa.
30. All'articolo 120 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
«1. Chiunque fa uso di sostanze stupefacenti e di sostanze psicotrope può chiedere al servizio pubblico per le tossicodipendenze o ad una struttura privata autorizzata ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi, di cui al comma 2, lettera d), del medesimo articolo di essere sottoposto ad accertamenti diagnostici e di eseguire un programma terapeutico e socio-riabilitativo»;
b) al comma 3, le parole: «dell'unità» sono sostituite dalle seguenti: «delle aziende unità» e dopo le parole: «unità sanitarie locali,» sono inserite le seguenti: «e con le strutture private autorizzate ai sensi dell'articolo 116»;
c) il comma 4 è sostituito dal seguente:
«4. Gli esercenti la professione medica che assistono persone dedite all'uso di sostanze stupefacenti e di sostanze psicotrope possono, in ogni tempo, avvalersi dell'ausilio del servizio pubblico per le tossicodipendenze e delle strutture private autorizzate ai sensi dell'articolo 116»;
d) il comma 7 è sostituito dal seguente:
«7. Gli operatori del servizio pubblico per le tossicodipendenze e delle strutture private autorizzate ai sensi dell'articolo 116, salvo l'obbligo di segnalare all'autorità competente tutte le violazioni commesse dalla persona sottoposta al programma terapeutico alternativo a sanzioni amministrative o ad esecuzione di pene detentive, non possono essere obbligati a deporre su quanto hanno conosciuto per ragione della propria professione, né davanti all'autorità giudiziaria né davanti ad altra autorità. Agli stessi si applicano le disposizioni dell'articolo 200 del codice di procedura penale e si estendono le garanzie previste per il difensore dalle disposizioni dell'articolo 103 del codice di procedura penale in quanto applicabili».
31. All'articolo 122 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
«1. Il servizio pubblico per le tossicodipendenze e le strutture private autorizzate ai sensi dell'articolo 116, compiuti i necessari accertamenti e sentito l'interessato, che può farsi assistere da un medico di fiducia autorizzato a presenziare anche agli accertamenti necessari, definiscono un programma terapeutico e socio-riabilitativo personalizzato che può prevedere, ove le condizioni psicofisiche del tossicodipendente lo consentano, in collaborazione con i centri di cui all'articolo 114 e avvedendosi delle cooperative di solidarietà sociale e delle associazioni di cui all'articolo 115, iniziative volte ad un pieno inserimento sociale attraverso l'orientamento e la formazione professionale, attività di pubblica utilità o di solidarietà sociale. Nell'ambito dei programmi terapeutici che lo prevedono, possono adottare metodologie di disassuefazione, nonché trattamenti psico-sociali e farmacologici adeguati. Il servizio per le tossicodipendenze controlla l'attuazione del programma da parte del tossicodipendente»;
b) al comma 2, le parole: «deve essere» sono sostituite dalla seguente: «viene» e dopo la parola: «studio» è inserita la seguente: «e»;
c) al comma 3, le parole: «riabilitative iscritte in un albo regionale o provinciale» sono sostituite dalle seguenti: «private autorizzate ai sensi dell'articolo 116»;
d) il comma 4 è sostituito dal seguente:
«4. Quando l'interessato ritenga di attuare il programma presso strutture private autorizzate ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi, di cui al comma 2, lettera d), del medesimo articolo, la scelta può cadere su qualsiasi struttura situata nel territorio nazionale che si dichiari di essere in condizioni di accoglierlo».
32. All'articolo 127 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 8 è sostituito dal seguente:
«8. I progetti di cui alle lettere a) e c) del comma 7 non possono prevedere la somministrazione delle sostanze stupefacenti o psicotrope incluse nella tabella I di cui all'articolo 14 e delle sostanze non inserite nella Farmacopea ufficiale, fatto salvo l'uso dei medicinali oppioidi prescrivibili, purché i dosaggi somministrati e la durata del trattamento abbiano l'esclusiva finalità clinico-terapeutica di avviare gli utenti a successivi programmi riabilitativi».
33. Al testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono aggiunte le seguenti tabelle, previste dagli articoli 13, comma 1, e 14 del citato testo unico, come modificati dai commi 2 e 3 del presente articolo.
Conseguentemente, sostituire l'Allegato A con il seguente:
















(Testo alternativo del relatore di minoranza, onorevole Rondini)
Sostituirlo con i seguenti:
Art. 1. – (Modificazioni all'articolo 73 del testo unico di cui al decreto del Presidente della Repubblica n. 309 del 1990). – 1. All'articolo 73 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) la rubrica è sostituita dalla seguente: «Produzione, traffico e detenzione illeciti di sostanze stupefacenti o psicotrope»;
b) il comma 1 è sostituito dal seguente:
«1. Chiunque, senza l'autorizzazione di cui all'articolo 17, coltiva, produce, fabbrica, estrae, raffina, vende, offre o mette in vendita, cede, distribuisce, commerci, trasporta, procura ad altri, invia, passa o spedisce in transito, consegna per qualunque scopo sostanze stupefacenti o psicotrope di cui alla tabella I prevista dall'articolo 14, è punito con la reclusione da sei a venti anni e con la multa da euro 26.000 a euro 260.000.»;
c) dopo il comma 1 è aggiunto il seguente:
«1-bis. Con le medesime pene di cui al comma 1 è punito chiunque, senza l'autorizzazione di cui all'articolo 17, importa, esporta, acquista, riceve a qualsiasi titolo o comunque illecitamente detiene:
a) sostanze stupefacenti o psicotrope che per quantità, in particolare se superiore ai limiti massimi indicati con decreto del Ministro della salute emanato di concerto con il Ministro della giustizia sentita la Presidenza del Consiglio dei Ministri – Dipartimento nazionale per le politiche antidroga, ovvero per modalità di presentazione, avuto riguardo al peso lordo complessivo o al confezionamento frazionato, ovvero per altre circostanze dell'azione, appaiono destinate ad un uso non esclusivamente personale;
b) medicinali contenenti sostanze stupefacenti o psicotrope elencate nella tabella II, sezione A, che eccedono il quantitativo prescritto. In questa ultima ipotesi, le pene suddette sono diminuite da un terzo alla metà.»;
d) il comma 2 è sostituito dal seguente:
«Chiunque, essendo munito dell'autorizzazione di cui all'articolo 17, illecitamente cede, mette o procura che altri metta in commercio le sostanze o le preparazioni indicate nelle tabelle le II di cui all'articolo 14, è punito con la reclusione da sei a ventidue anni e con la multa da euro 26.000 a euro 300.000.»;
e) dopo il comma 2 è aggiunto il seguente:
«2-bis. Le pene di cui al comma 2 si applicano anche nel caso di illecita produzione o commercializzazione delle sostanze chimiche di base e dei precursori di cui alle categorie 1, 2 e 3 dell'allegato I al presente testo unico, utilizzabili nella produzione clandestina delle sostanze stupefacenti o psicotrope previste nelle tabelle di cui all'articolo 14.»;
f) i commi 3, 4 e 5 sono sostituiti dai seguenti:
«3. Le stesse pene si applicano a chiunque coltiva, produce o fabbrica sostanze stupefacenti o psicotrope diverse da quelle stabilite nel decreto di autorizzazione.
4. Quando le condotte di cui al comma 1 riguardano i medicinali ricompresi nella tabella II, sezioni A, B e C, di cui all'articolo 14 e non ricorrono le condizioni di cui all'articolo 17, si applicano le pene ivi stabilite, diminuite da un terzo alla metà.
5. Quando, per i mezzi, per la modalità o le circostanze dell'azione ovvero per la qualità e quantità delle sostanze, i fatti previsti dal presente articolo sono di lieve entità, si applicano le pene della reclusione da uno a sei anni e della multa da euro 3.000 a euro 26.000.»;
g) dopo il comma 5 è aggiunto il seguente:
«5-bis. Nell'ipotesi di cui al comma 5, limitatamente ai reati di cui al presente articolo commessi da persona tossicodipendente o da assuntore di sostanze stupefacenti o psicotrope, il giudice, con la sentenza di condanna o di applicazione della pena su richiesta delle parti a norma dell'articolo 444 del codice di procedura penale, su richiesta dell'imputato e sentito il pubblico ministero, qualora non debba concedersi il beneficio della sospensione condizionale della pena, può applicare, anziché le pene detentive e pecuniarie, quella del lavoro di pubblica utilità di cui all'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, secondo le modalità ivi previste. Con la sentenza il giudice incarica l'Ufficio locale di esecuzione penale esterna di verificare l'effettivo svolgimento del lavoro di pubblica utilità. L'Ufficio riferisce periodicamente al giudice. In deroga a quanto disposto dall'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, il lavoro di pubblica utilità ha una durata corrispondente a quella della sanzione detentiva irrogata. Esso può essere disposto anche nelle strutture private autorizzate ai sensi dell'articolo 116, previo consenso delle stesse. In caso di violazione degli obblighi connessi allo svolgimento del lavoro di pubblica utilità, in deroga a quanto previsto dall'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, su richiesta del pubblico ministero o d'ufficio, il giudice che procede, o quello dell'esecuzione, con le formalità di cui all'articolo 666 del codice di procedura penale, tenuto conto dell'entità dei motivi e delle circostanze della violazione, dispone la revoca della pena con conseguente ripristino di quella sostituita. Avverso tale provvedimento di revoca è ammesso ricorso per Cassazione, che non ha effetto sospensivo. Il lavoro di pubblica utilità può sostituire la pena per non più di due volte.»
Art. 1-bis. – (Ulteriori modificazioni al testo unico di cui al decreto del Presidente della Repubblica n. 309 del 1990). – 1. All'articolo 2, comma 1, lettera e), del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il numero 2) è sostituito dal seguente:
«2) il completamento e l'aggiornamento delle tabelle di cui all'articolo 13, sentiti il Consiglio superiore di sanità e la Presidenza del Consiglio dei Ministri-Dipartimento nazionale per le politiche antidroga»;
2. All'articolo 13 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
1. Le sostanze stupefacenti o psicotrope sottoposte alla vigilanza ed al controllo del Ministero della salute sono raggruppate, in conformità ai criteri di cui all'articolo 14, in due tabelle, allegate al presente testo unico. Il Ministero della sedute stabilisce con proprio decreto il completamento e l'aggiornamento delle tabelle con le modalità di cui all'articolo 2, comma 1, lettera e), numero 2);
b) il comma 3 è abrogato;
c) il comma 5 è sostituito dal seguente:
5. Il Ministero della salute, sentiti il Consiglio superiore di sanità e la Presidenza del Consiglio dei Ministri – Dipartimento nazionale per le politiche antidroga, ed in accordo con le convenzioni internazionali in materia di sostanze stupefacenti o psicotrope, dispone con apposito decreto l'esclusione da una o più misure di controllo di quei medicinali e dispositivi diagnostici che per la loro composizione qualitativa e quantitativa non possono trovare un uso diverso da quello cui sono destinati.
3. L'articolo 14 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
Art. 14 – (Criteri per la formazione delle tabelle). – 1. La inclusione delle sostanze stupefacenti o psicotrope nelle tabelle di cui all'articolo 13 è effettuata in base ai seguenti criteri:
a) nella tabella I sono indicati:
1) l'oppio e i materiali da cui possono essere ottenute le sostanze oppiacee naturali, estraibili dal papavero sonnifero; gli alcaloidi ad azione narcotico-analgesica da esso estraibili; le sostanze ottenute per trasformazione chimica di quelle prima indicate; le sostanze ottenibili per sintesi che siano riconducibili, per struttura chimica o per effetti, a quelle oppiacee precedentemente indicate; eventuali intermedi per la loro sintesi;
2) le foglie di coca e gli alcaloidi ad azione eccitante sul sistema nervoso centrale da queste estraibili; le sostanze ad azione analoga ottenute per trasformazione chimica degli alcaloidi sopra indicati oppure per sintesi;
3) le sostanze di tipo amfetaminico ad azione eccitante sul sistema nervoso centrale;
4) ogni altra sostanza che produca effetti sul sistema nervoso centrale ed abbia capacità di determinare dipendenza fisica o psichica dello stesso ordine o di ordine superiore a quelle precedentemente indicate;
5) gli indolici, siano essi derivati triptaminici che lisergici, e i derivati feniletilamminici, che abbiano effetti allucinogeni o che possano provocare distorsioni sensoriali;
6) la cannabis indica, i prodotti da essa ottenuti; i tetraidrocannabinoli, i loro analoghi naturali, le sostanze ottenute per sintesi o semisintesi che siano ad essi riconducibili per struttura chimica o per effetto farmaco-tossicologico;
7) ogni altra pianta i cui principi attivi possono provocare allucinazioni o gravi distorsioni sensoriali e tutte le sostanze ottenute per estrazione o per sintesi chimica che provocano la stessa tipologia di effetti a carico del sistema nervoso centrale;
b) nella sezione A della tabella II sono indicati:
1) i medicinali contenenti le sostanze analgesiche oppiacee naturali, di semisintesi e di sintesi;
2) i medicinali di cui all'allegato III-bis al presente testo unico;
3) i medicinali contenenti sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di grave dipendenza fisica o psichica;
4) i barbiturici che hanno notevole capacità di indurre dipendenza fisica o psichica o entrambe, nonché altre sostanze ad effetto ipnotico-sedativo ad essi assimilabili ed i medicinali che li contengono;
c) nella sezione B della tabella II sono indicati:
1) i medicinali che contengono sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica di intensità e gravità minori di quelli prodotti dai medicinali elencati nella sezione A;
2) i barbiturici ad azione antiepilettica e i barbiturici con breve durata d'azione;
3) le benzodiazepine, i derivati pirazolopirimidinici ed i loro analoghi ad azione ansiolitica o psicostimolante che possono dar luogo al pericolo di abuso e generare farmacodipendenza;
d) nella sezione C della tabella II sono indicati:
1) le composizioni medicinali contenenti le sostanze elencate nella tabella II, sezione B, da sole o in associazione con altri principi attivi, per i quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica;
e) nella sezione D della tabella II sono indicati:
1) le composizioni medicinali contenenti le sostanze elencate nella tabella II, sezioni A o B, da sole o in associazione con altri principi attivi quando per la loro composizione qualitativa e quantitativa e per le modalità del loro uso, presentano rischi di abuso o farmacodipendenza di grado inferiore a quello delle composizioni medicinali comprese nella tabella II, sezioni A e C, e pertanto non sono assoggettate alla disciplina delle sostanze che entrano a far parte della loro composizione;
2) le composizioni medicinali ad uso parenterale a base di benzodiazepine;
3) le composizioni medicinali per uso diverso da quello iniettabile, le quali, in associazione con altri principi attivi non stupefacenti contengono alcaloidi totali dell'oppio con equivalente ponderale in morfina non superiore allo 0,05 per cento in peso espresso come base anidra; le suddette composizioni medicinali devono essere tali da impedire praticamente il recupero dello stupefacente con facili ed estemporanei procedimenti estrattivi;
f) nella sezione E della tabella II sono indicati:
1) le composizioni medicinali contenenti le sostanze elencate nella tabella II, sezioni A o B, da sole o in associazione con altri principi attivi, quando per la loro composizione qualitativa e quantitativa o per le modalità del loro uso, possono dar luogo a pericolo di abuso o generare farmacodipendenza di grado inferiore a quello delle composizioni medicinali elencate nella tabella II, sezioni A, C o D.
2. Nelle tabelle le II sono compresi, ai fini della applicazione del presente testo unico, tutti gli isomeri, gli esteri, gli eteri, ed i sali anche relativi agli isomeri, esteri ed eteri, nonché gli stereoisomeri nei casi in cui possono essere prodotti, relativi alle sostanze ed ai preparati inclusi nelle tabelle, salvo sia fatta espressa eccezione.
3. Le sostanze incluse nelle tabelle sono indicate con la denominazione comune internazionale, il nome chimico, la denominazione comune italiana o l'acronimo, se esiste. È, tuttavia, ritenuto sufficiente, ai fini della applicazione del presente testo unico, che nelle tabelle la sostanza sia indicata con almeno una delle denominazioni sopra indicate, purché idonea ad identificarla.
4. Le sostanze e le piante di cui al comma 1, lettera a), sono soggette alla disciplina del presente testo unico anche quando si presentano sotto ogni forma di prodotto, miscuglio o miscela.
4. All'articolo 26 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
1. Salvo quanto stabilito nel comma 2, è vietata nel territorio dello Stato la coltivazione delle piante comprese nella tabella I di cui all'articolo 14.
5. All'articolo 31 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 1, le parole: «I, II, III, IV e V» sono sostituite dalle seguenti: «le II, sezioni A e B».
6. All'articolo 34 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
1. Presso ciascun ente o impresa, autorizzati alla fabbricazione di sostanze stupefacenti o psicotrope, comprese nelle tabelle le II, sezione A, di cui all'articolo 14, devono essere dislocati uno o più militari della Guardia di finanza per il controllo dell'entrata e dell'uscita delle sostanze stupefacenti o psicotrope, nonché per la sorveglianza a carattere continuativo durante i cicli di lavorazione.
7. All'articolo 35 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 1, le parole: «I, II, III, IV e VI» sono sostituite dalle seguenti: «le II, sezioni A e B».
8. All'articolo 36 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «I, II, III, IV e V» sono sostituite dalle seguenti: «I e II»;
b) al comma 3, le parole: «delle preparazioni ottenute» sono sostituite dalle seguenti: «dei prodotti ottenuti».
9. All'articolo 38 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
1. La vendita o cessione, a qualsiasi titolo, anche gratuito, delle sostanze e dei medicinali compresi nelle tabelle le II di cui all'articolo 14 deve essere fatta alle persone autorizzate a norma del presente testo unico in base a richiesta scritta da staccarsi da apposito bollettario «buoni acquisto» conforme al modello predisposto e distribuito dal Ministero della salute. La richiesta scritta non è necessaria per la vendita o cessione a qualsiasi titolo ai titolari o direttori di farmacie aperte al pubblico o ospedaliere per quanto attiene ai medicinali compresi nella tabella II, sezioni D ed E, acquistati presso le imprese autorizzate al commercio all'ingrosso. I titolari o i direttori di farmacie aperte al pubblico o ospedaliere possono utilizzare il bollettario «buoni acquisto» anche per richiedere, a titolo gratuito, i medicinali compresi nella tabella II, sezioni A, B e C, ad altre farmacie aperte al pubblico o ospedaliere, qualora si configuri il carattere di urgenza terapeutica;
b) dopo il comma 1 è inserito il seguente:
1-bis. Il Ministero della salute dispone, con proprio decreto, il modello di bollettario «buoni acquisto» adatto alle richieste cumulative.
10. Il comma 1 dell'articolo 40 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
1. Il Ministero della salute, nel rispetto delle normative comunitarie, al momento dell'autorizzazione all'immissione in commercio, determina, in rapporto alla loro composizione, indicazione terapeutica e posologia, le confezioni dei medicinali contenenti sostanze stupefacenti o psicotrope che possono essere messe in commercio ed individua, in applicazione dei criteri di cui all'articolo 14, la sezione della tabella II in cui collocare il medicinale stesso.
11. All'articolo 41 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, lettera d), le parole: «previste dall'articolo 14» sono sostituite dalle seguenti: «, sezione A, di cui all'articolo 14»;
b) al comma 1-bis, la parola: «farmaci» è sostituita dalla seguente: «medicinali».
12. All'articolo 42 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) la rubrica è sostituita dalla seguente: «Acquisto di medicinali a base di sostanze stupefacenti e di sostanze psicotrope da parte di medici chirurghi»;
b) il comma 1 è sostituito dal seguente:
1. I medici chirurghi ed i medici veterinari, i direttori sanitari o responsabili di ospedali, case di cura in genere, prive dell'unità operativa di farmacia, e titolari di gabinetto per l'esercizio delle professioni sanitarie qualora, per le normali esigenze terapeutiche, si determini la necessità di approvvigionarsi di medicinali a base di sostanze stupefacenti o psicotrope compresi nella tabella II, sezioni A, B e C, di cui all'articolo 14, devono farne richiesta scritta in triplice copia alla farmacia o al grossista di medicinali. La prima delle predette copie rimane per documentazione al richiedente; le altre due devono essere rimesse alla farmacia o alla ditta all'ingrosso; queste ultime ne trattengono una per il proprio discarico e trasmettono l'altra all'azienda sanitaria locale a cui fanno riferimento;
c) al comma 2, le parole: «delle predette preparazioni» sono sostituite dalle seguenti: «dei predetti medicinali» e le parole: «lire duecentomila a lire un milione» sono sostituite dalle seguenti: «euro 100 ad euro 500»;
d) al comma 3, le parole: «delle preparazioni acquistate» sono sostituite dalle seguenti: «dei medicinali acquistati» e le parole: «delle preparazioni stesse» sono sostituite dalle seguenti: «dei medicinali stessi».
13. L'articolo 43 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
Art. 43 – (Obblighi dei medici chirurghi e dei medici veterinari). – 1. I medici chirurghi e i medici veterinari prescrivono i medicinali compresi nella tabella II, sezione A, di cui all'articolo 14, su apposito ricettario approvato con decreto del Ministero della salute.
2. La prescrizione dei medicinali indicati nella tabella II, sezione A, di cui all'articolo 14 può comprendere un solo medicinale per una cura di durata non superiore a trenta giorni, ad eccezione della prescrizione dei medicinali di cui all'allegato III-bis per i quali la ricetta può comprendere fino a due medicinali diversi tra loro o uno stesso medicinale con due dosaggi differenti per una cura di durata non superiore a trenta giorni.
3. Nella ricetta devono essere indicati:
a) cognome e nome dell'assistito ovvero del proprietario dell'animale ammalato;
b) la dose prescritta, la posologia ed il modo di somministrazione;
c) l'indirizzo e il numero telefonico professionali del medico chirurgo o del medico veterinario da cui la ricetta è rilasciata;
d) la data e la firma del medico chirurgo o del medico veterinario da cui la ricetta è rilasciata;
e) il timbro personale del medico chirurgo o del medico veterinario da cui la ricetta è rilasciata.
4. Le ricette di cui al comma 1 sono compilate in duplice copia a ricalco per i medicinali non forniti dal Servizio sanitario nazionale, ed in triplice copia a ricalco per i medicinali forniti dal Servizio sanitario nazionale. Una copia della ricetta è comunque conservata dall'assistito o dal proprietario dell'animale ammalato. Il Ministero della salute stabilisce con proprio decreto la forma ed il contenuto del ricettario di cui al comma 1.
5. La prescrizione dei medicinali compresi nella tabella II, sezione A, di cui all'articolo 14, qualora utilizzati per il trattamento di disassuefazione dagli stati di tossicodipendenza da oppiacei o di alcooldipendenza, è effettuata utilizzando il ricettario di cui al comma 1 nel rispetto del piano terapeutico predisposto da una struttura sanitaria pubblica o da una struttura privata autorizzata ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi di cui al comma 2, lettera d), del medesimo articolo. La persona alla quale sono consegnati in affidamento i medicinali di cui al presente comma è tenuta ad esibire a richiesta la prescrizione medica o il piano terapeutico in suo possesso.
6. I medici chirurghi e i medici veterinari sono autorizzati ad approvvigionarsi attraverso autoricettazione, a trasportare e a detenere i medicinali compresi nell'allegato III-bis per uso professionale urgente, utilizzando il ricettario di cui al comma 1. Una copia della ricetta è conservata dal medico chirurgo o dal medico veterinario che tiene un registro delle prestazioni effettuate, annotandovi le movimentazioni, in entrata ed uscita, dei medicinali di cui si è approvvigionato e che successivamente ha somministrato. Il registro delle prestazioni non è di modello ufficiale e deve essere conservato per due anni a far data dall'ultima registrazione effettuata; le copie delle autoricettazioni sono conservate, come giustificativo dell'entrata, per lo stesso periodo del registro.
7. Il personale che opera nei distretti sanitari di base o nei servizi territoriali o negli ospedali pubblici o accreditati delle aziende sanitarie locali è autorizzato a consegnare al domicilio di pazienti affetti da dolore severo in corso di patologia neoplastica o degenerativa, ad esclusione del trattamento domiciliare degli stati di tossicodipendenza da oppiacei, le quantità terapeutiche dei medicinali compresi nell'allegato III-bis accompagnate dalla certificazione medica che ne prescrive la posologia e l'utilizzazione nell'assistenza domiciliare.
8. Gli infermieri professionali che effettuano servizi di assistenza domiciliare nell'ambito dei distretti sanitari di base o nei servizi territoriali delle aziende sanitarie locali e i familiari dei pazienti, opportunamente identificati dal medico o dal farmacista che ivi effettuano servizio, sono autorizzati a trasportare le quantità terapeutiche dei medicinali compresi nell'allegato III-bis accompagnate dalla certificazione medica che ne prescrive la posologia e l'utilizzazione a domicilio di pazienti affetti da dolore severo in corso di patologia neoplastica o degenerativa, ad esclusione del trattamento domiciliare degli stati di tossicodipendenza da oppiacei.
9. La prescrizione dei medicinali compresi nella tabella II, sezioni B, C e D, di cui all'articolo 14 è effettuata con ricetta da rinnovarsi volta per volta e da trattenersi da parte del farmacista.
10. La prescrizione dei medicinali compresi nella tabella II, sezione E, di cui all'articolo 14 è effettuata con ricetta medica.
14. L'articolo 45 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
Art. 45 – (Dispensazione dei medicinali). – 1. La dispensazione dei medicinali compresi nella tabella II, sezione A, di cui all'articolo 14 è effettuata dal farmacista che si accerta dell'identità dell'acquirente e prende nota degli estremi di un documento di riconoscimento da trascrivere sulla ricetta.
2. Il farmacista dispensa i medicinali di cui al comma 1 dietro presentazione di prescrizione medica compilata sulle ricette previste dal comma 1 dell'articolo 43 nella quantità e nella forma farmaceutica prescritta.
3. Il farmacista ha l'obbligo di accertare che la ricetta sia stata redatta secondo le disposizioni stabilite nell'articolo 43, di annotarvi la data di spedizione e di apporvi il timbro della farmacia e di conservarla tenendone conto ai fini del discarico dei medicinali sul registro di entrata e uscita di cui al comma 1 dell'articolo 60.
4. La dispensazione dei medicinali di cui alla tabella II, sezioni B e C, è effettuata dal farmacista dietro presentazione di ricetta medica da rinnovarsi volta per volta. Il farmacista appone sulla ricetta la data di spedizione e il timbro della farmacia e la conserva tenendone conto ai fini del discarico dei medicinali sul registro di entrata e di uscita di cui all'articolo 60, comma 1.
5. Il farmacista conserva per due anni, a partire dal giorno dell'ultima registrazione nel registro di cui all'articolo 60, comma 1, le ricette che prescrivono medicinali compresi nella tabella II, sezioni A, B e C. Nel caso di fornitura di medicinali a carico del Servizio sanitario nazionale, il farmacista è tenuto a conservare una copia della ricetta originale o fotocopia della ricetta originale, recante la data di spedizione.
6. La dispensazione dei medicinali di cui alla tabella II, sezione D, è effettuata dal farmacista dietro presentazione di ricetta medica da rinnovarsi volta per volta.
7. La dispensazione dei medicinali di cui alici tabella II, sezione E, è effettuata dal farmacista dietro presentazione di ricetta medica.
8. Decorsi trenta giorni dalla data del rilascio, la prescrizione medica non può essere più spedita.
9. Salvo che il fatto costituisca reato, il contravventore alle disposizioni del presente articolo è soggetto alla sanzione amministrativa pecuniaria del pagamento di una somma da euro 100 ad euro 600.
10. Il Ministro della salute provvede a stabilire, con proprio decreto, tenuto conto di quanto previsto dal decreto ministeriale 15 luglio 2004 in materia di tracciabilità di medicinali, la forma ed il contenuto dei moduli idonei al controllo del movimento dei medicinali a base di sostanze stupefacenti o psicotrope tra le farmacie interne degli ospedali e singoli reparti.
15. All'articolo 46 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «delle preparazioni indicate nelle tabelle I, II, III, IV e V previste» sono sostituite dalle seguenti: «dei medicinali compresi nella tabella II, sezioni A, C e D, prevista»;
b) al comma 4, le parole: «delle preparazioni» sono sostituite dalle seguenti: «dei medicinali».
16. All'articolo 47 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «delle preparazioni indicate nelle tabelle I, II, III, IV e V previste» sono sostituite dalle seguenti: «dei medicinali compresi nella tabella II, sezioni A, C e D, prevista»;
b) al comma 4, le parole: «delle preparazioni» sono sostituite dalle seguenti: «dei medicinali».
17. All'articolo 54 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) al comma 1, le parole: «I, II, III, IV e V» sono sostituite dalle seguenti: «I e II, sezioni A e B,»;
b) al comma 2, le parole: «I, II, e III» sono sostituite dalle seguenti: «I e II, sezione A,».
18. L'articolo 60 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
Art. 60 – (Registro di entrata e uscita). – 1. Ogni acquisto o cessione, anche a titolo gratuito, di sostanze e di medicinali di cui alle tabelle previste dall'articolo 14, è iscritto in un registro speciale nel quale, senza alcuna lacuna, abrasione o aggiunta, in ordine cronologico, secondo una progressione numerica unica per ogni sostanza o medicinale, è tenuto in evidenza il movimento di entrata e di uscita delle stesse sostanze o medicinali. Tale registro è numerato e firmato in ogni pagina dal responsabile dell'azienda unità sanitaria locale o da un suo delegato che riporta nella prima pagina gli estremi della autorizzazione ministeriale e dichiara nell'ultima il numero delle pagine di cui il registro è costituito. Il registro è conservato da parte degli enti e delle imprese autorizzati alla fabbricazione, per la durata di dieci anni dal giorno dell'ultima registrazione. Detto termine è ridotto a cinque anni per le officine autorizzate all'impiego e per le imprese autorizzate al commercio all'ingrosso.
2. I responsabili delle farmacie aperte al pubblico e delle farmacie ospedaliere riportano sul registro il movimento dei medicinali di cui alla tabella II, sezioni A, B e C secondo le modalità indicate al comma precedente.
3. Le unità operative delle strutture sanitarie pubbliche e private, nonché le unità operative dei servizi territoriali delle aziende sanitarie locali sono dotate di registro di carico e scarico dei medicinali di cui alla tabella II, sezioni A, B e C, prevista dall'articolo 14.
4. I registri di cui ai commi 1 e 3 sono conformi ai modelli predisposti dal Ministero della salute.
5. In alternativa ai registri di cui ai commi 1 e 3, il Ministero della salute stabilisce con proprio decreto le modalità di registrazione su supporto informatico della movimentazione delle sostanze e dei medicinali di cui alle tabelle previste dall'articolo 14.
6. Il registro di cui al comma 3 è vidimato dal direttore sanitario, o da un suo delegato, che provvede alla sua distribuzione. Il registro è conservato, in ciascuna unità operativa, dal responsabile dell'assistenza infermieristica per due anni dalla data dell'ultima registrazione.
7. Il dirigente medico preposto all'unità operativa è responsabile della effettiva corrispondenza tra la giacenza contabile e quella reale dei medicinali di cui alla tabella II, sezioni A, B e C, prevista dall'articolo 14.
8. Il direttore responsabile del servizio farmaceutico compie periodiche ispezioni per accertare la corretta tenuta dei registri di reparto di cui al comma 3 e redige apposito verbale da trasmettere alla direzione sanitaria.
19. All'articolo 61 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
1. Nel registro di cui all'articolo 60, comma 1, tenuto da enti e imprese autorizzati alla fabbricazione di sostanze stupefacenti o psicotrope nonché dei medicinali, compresi nelle tabelle di cui all'articolo 14, è annotata ciascuna operazione di entrata e di uscita o di passaggio in lavorazione.
20. All'articolo 62 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
1. Il registro di cui all'articolo 60, comma 1, tenuto dagli enti e imprese autorizzati all'impiego ed al commercio di sostanze stupefacenti o psicotrope nonché dei medicinali di cui alle tabelle previste dall'articolo 14 ed il registro delle farmacie per quanto concerne i medicinali di cui alla tabella II, sezioni A e C, dell'articolo 14, sono chiusi al 31 dicembre di ogni anno. La chiusura si compie mediante scritturazione riassuntiva di tutti i dati comprovanti i totali delle qualità e quantità dei prodotti avuti in carico e delle quantità e qualità dei prodotti impiegati o commercializzati durante l'anno, con l'indicazione di ogni eventuale differenza o residuo.
21. All'articolo 63 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
1. Gli enti o le imprese autorizzati alla fabbricazione di sostanze stupefacenti o psicotrope nonché dei medicinali compresi nelle tabelle di cui all'articolo 14 tengono anche un registro di lavorazione, numerato e firmato in ogni pagina da un funzionario del Ministero della sedute all'uopo delegato, nel quale sono iscritte le quantità di materie prime poste in lavorazione, con indicazione della loro esatta denominazione e della data di entrata nel reparto di lavorazione, nonché i prodotti ottenuti da ciascuna lavorazione.
22. Il comma 1 dell'articolo 65 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
1. Gli enti e le imprese autorizzati alla produzione, alla fabbricazione e all'impiego di sostanze stupefacenti o psicotrope nonché dei medicinali, compresi nelle tabelle di cui all'articolo 14, trasmettono al Ministero della salute, alla Direzione centrale per i servizi antidroga e alla competente unità sanitaria locale annualmente, non oltre il 31 gennaio di ciascun anno, i dati riassuntivi dell'anno precedente e precisamente:
a) i risultati di chiusura del registro di carico e scarico;
b) la quantità e qualità delle sostanze utilizzate per la produzione di medicinali preparati nel corso dell'anno;
c) la quantità e la qualità dei medicinali venduti nel corso dell'anno;
d) la quantità e la qualità delle giacenze esistenti al 31 dicembre.
23. All'articolo 66 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
1. Gli enti e le imprese autorizzati ai sensi dell'articolo 17 che abbiano effettuato importazioni o esportazioni di sostanze stupefacenti o psicotrope nonché di medicinali compresi nelle tabelle di cui all'articolo 14, trasmettono al Ministero della salute, entro quindici giorni dalla fine di ogni trimestre, i dati relativi ai permessi di importazione o di esportazione utilizzati nel corso del trimestre precedente. Gli enti e le imprese autorizzati alla fabbricazione trasmettono, altresì, un rapporto sulla natura e quantità delle materie prime ricevute e di quelle utilizzate per la lavorazione degli stupefacenti o sostanze psicotrope nonché dei medicinali ricavati, e di quelli venduti nel corso del trimestre precedente. In tale rapporto, per l'oppio grezzo, nonché per le foglie e pasta di coca è indicato il titolo in principi attivi ad azione stupefacente.
24. Gli articoli 69 e 71 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono abrogati.
25. All'articolo 79 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 1 è sostituito dal seguente:
1. Chiunque adibisce o consente che sia adibito un locale pubblico o un circolo privato di qualsiasi specie a luogo di convegno di persone che ivi si danno all'uso di sostanze stupefacenti o psicotrope è punito, per questo solo fatto, con la reclusione da tre a dieci anni e con la multa da euro 3.000 ad euro 10.000 se l'uso riguarda le sostanze e i medicinali compresi nelle tabelle le II, sezione A, previste dall'articolo 14, o con la reclusione da uno a quattro anni e con la multa da euro 3.000 ad euro 26.000 se l'uso riguarda i medicinali compresi nella tabella II, sezione B, prevista dallo stesso articolo 14.
26. All'articolo 82 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 4, le parole: «le sostanze di cui alle tabelle II e IV previste» sono sostituite dalle seguenti: «i medicinali di cui alla tabella II, sezione B, prevista.
27. All'articolo 114 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 2 è sostituito dal seguente:
2. Il perseguimento degli obiettivi previsti dal comma 1 può essere affidato dai comuni e dalle comunità montane o dalle loro associazioni alle competenti aziende unità sanitarie locali o alle strutture private autorizzate ai sensi dell'articolo 116.
28. All'articolo 115 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, al comma 1 la parola: «ausiliari» è soppressa.
29. All'articolo 120 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
1. Chiunque fa uso di sostanze stupefacenti e di sostanze psicotrope può chiedere al servizio pubblico per le tossicodipendenze o ad una struttura privata autorizzata ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi, di cui al comma 2, lettera d), del medesimo articolo di essere sottoposto ad accertamenti diagnostici e di eseguire un programma terapeutico e socio-riabilitativo;
b) al comma 3, le parole: «dell'unita» sono sostituite dalle seguenti: «delle aziende unita» e dopo le parole: «unità sanitarie locali,» sono inserite le seguenti: «e con le strutture private autorizzate ai sensi dell'articolo 116»;
c) il comma 4 è sostituito dal seguente:
4. Gli esercenti la professione medica che assistono persone dedite all'uso di sostanze stupefacenti e di sostanze psicotrope possono, in ogni tempo, avvalersi dell'ausilio del servizio pubblico per le tossicodipendenze e delle strutture private autorizzate ai sensi dell'articolo 116;
d) il comma 7 è sostituito dal seguente:
7. Gli operatori del servizio pubblico per le tossicodipendenze e delle strutture private autorizzate ai sensi dell'articolo 116, salvo l'obbligo di segnalare all'autorità competente tutte le violazioni commesse dalla persona sottoposta al programma terapeutico alternativo a sanzioni amministrative o ad esecuzione di pene detentive, non possono essere obbligati a deporre su quanto hanno conosciuto per ragione della propria professione, né davanti all'autorità giudiziaria né davanti ad altra autorità. Agli stessi si applicano le disposizioni dell'articolo 200 del codice di procedura penale e si estendono le garanzie previste per il difensore dalle disposizioni dell'articolo 103 del codice di procedura penale in quanto applicabili.
30. All'articolo 122 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono apportate le seguenti modificazioni:
a) il comma 1 è sostituito dal seguente:
1. Il servizio pubblico per le tossicodipendenze e le strutture private autorizzate ai sensi dell'articolo 116, compiuti i necessari accertamenti e sentito l'interessato, che può farsi assistere da un medico di fiducia autorizzato a presenziare anche agli accertamenti necessari, definiscono un programma terapeutico e socio-riabilitativo personalizzato che può prevedere, ove le condizioni psicofisiche del tossicodipendente lo consentano, in collaborazione con i centri di cui all'articolo 114 e avvedendosi delle cooperative di solidarietà sociale e delle associazioni di cui all'articolo 115, iniziative volte ad un pieno inserimento sociale attraverso l'orientamento e la formazione professionale, attività di pubblica utilità o di solidarietà sociale. Nell'ambito dei programmi terapeutici che lo prevedono, possono adottare metodologie di disassuefazione, nonché trattamenti psico-sociali e farmacologici adeguati. Il servizio per le tossicodipendenze controlla l'attuazione del programma da parte del tossicodipendente;
b) al comma 2, le parole: «deve essere» sono sostituite dalla seguente: «viene» e dopo la parola: «studio» è inserita la seguente: «e»;
c) al comma 3, le parole: «riabilitative iscritte in un albo regionale o provinciale» sono sostituite dalle seguenti: «private autorizzate ai sensi dell'articolo 116»;
d) il comma 4 è sostituito dal seguente:
4. Quando l'interessato ritenga di attuare il programma presso strutture private autorizzate ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi, di cui al comma 2, lettera d), del medesimo articolo, la scelta può cadere su qualsiasi struttura situata nel territorio nazionale che si dichiari di essere in condizioni di accoglierlo.
31. All'articolo 127 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, il comma 8 è sostituito dal seguente:
8. I progetti di cui alle lettere a) e c) del comma 7 non possono prevedere la somministrazione delle sostanze stupefacenti o psicotrope incluse nella tabella I di cui all'articolo 14 e delle sostanze non inserite nella Farmacopea ufficiale, fatto salvo l'uso dei medicinali oppioidi prescrivibili, purché i dosaggi somministrati e la durata del trattamento abbiano l'esclusiva finalità clinico-terapeutica di avviare gli utenti a successivi programmi riabilitativi.
32. Al testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono aggiunte le seguenti tabelle, previste dagli articoli 13, comma 1, e 14 del citato testo unico, come modificati dai commi 2 e 3 del presente articolo.
Conseguentemente, sostituire l'Allegato A con il seguente:
















1. 505. Rondini, Molteni.
Al comma 1, lettera a), sostituire le parole: l'Istituto superiore di sanità con le seguenti: la Presidenza del Consiglio dei Ministri-Dipartimento nazionale per le politiche antidroga.
Conseguentemente, al comma 2, lettera c), capoverso comma 5, sostituire le parole: l'Istituto superiore di sanità con le seguenti: la Presidenza del Consiglio dei Ministri-Dipartimento nazionale per le politiche antidroga.
1. 102. Giorgia Meloni, Rampelli.
Al comma 1, lettera a), dopo le parole: Istituto superiore di sanità; aggiungere le seguenti: qualora il completamento o l'aggiornamento delle tabelle comportasse modifiche intertabellari queste possono essere apportate esclusivamente con provvedimento legislativo.
Conseguentemente, al comma 2, dopo la lettera a), aggiungere la seguente:
a-bis) dopo il comma 1 è aggiunto il seguente:
«1-bis. Il completamento o l'aggiornamento delle tabelle di cui al comma 1 che comporti modifiche intertabellari è consentito esclusivamente con apposito provvedimento legislativo.»
1. 20. Baroni, Cecconi, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Lorefice, Mantero.
Al comma 2, lettera a), capoverso comma 1, primo periodo, sostituire le parole da: e i medicinali fino a: cinque tabelle con le seguenti: sono raggruppate, in conformità ai criteri di cui all'articolo 14, in quattro tabelle.
1. 592. Giorgia Meloni, Rampelli.
Sostituire il comma 3 con il seguente:
3. L'articolo 14 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 14. – (Criteri per la formazione delle tabelle). – 1. La inclusione delle sostanze stupefacenti o psicotrope nelle tabelle di cui all'articolo 13 è effettuata in base ai seguenti criteri:
a) nella tabella I devono essere indicati:
1) l'oppio e i materiali da cui possono essere ottenute le sostanze oppiacee naturali, estraibili dal papavero sonnifero; gli alcaloidi ad azione narcotico-analgesica da esso estraibili; le sostanze ottenute per trasformazione chimica di quelle prima indicate; le sostanze ottenibili per sintesi che siano riconducibili, per struttura chimica o per effetti, a quelle oppiacee precedentemente indicate; eventuali intermedi per la loro sintesi;
2) le foglie di coca e gli alcaloidi ad azione eccitante sul sistema nervoso centrale da queste estraibili; le sostanze ad azione analoga ottenute per trasformazione chimica degli alcaloidi sopra indicati oppure per sintesi;
3) le sostanze di tipo amfetaminico ad azione eccitante sul sistema nervoso centrale;
4) ogni altra sostanza che produca effetti sul sistema nervoso centrale ed abbia capacità di determinare dipendenza fisica o psichica dello stesso ordine o di ordine superiore a quelle precedentemente indicate;
5) gli indolici, siano essi derivati triptaminici che lisergici, e i derivati feniletilamminici, che abbiano effetti allucinogeni o che possano provocare distorsioni sensoriali;
6) i tetraidrocannabinoli, i loro analoghi, le sostanze ottenute per sintesi o semisintesi che siano ad essi riconducibili per struttura chimica o per effetto farmaco-tossicologico;
7) ogni altra pianta o sostanza naturale o sintetica che possa provocare allucinazioni o gravi distorsioni sensoriali e tutte le sostanze ottenute per estrazione o per sintesi chimica che provocano la stessa tipologia di effetti a carico del sistema nervoso centrale;
8) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera d);
9) la cannabis indica e i prodotti da essa ottenuti;
10) le preparazioni contenenti cannabis indica, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera d);
b) nella tabella II devono essere indicati:
1) i barbiturici che hanno notevole capacità di indurre dipendenza fisica o psichica o entrambe, nonché altre sostanze ad effetto ipnotico-sedativo ad essi assimilabili. Sono pertanto esclusi i barbiturici a lunga durata e di accertato effetto antiepilettico e i barbiturici a breve durata di impiego quali anestetici generali, sempre che tutte le dette sostanze non comportino i pericoli di dipendenza innanzi indicati;
2) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera d);
c) nella tabella III devono essere indicate:
1) le sostanze per le quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica di intensità e gravità minori di quelli prodotti dalle sostanze elencate nelle tabelle I e II;
2) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera d);
d) nella tabella denominata «tabella dei medicinali» e suddivisa in cinque sezioni, sono indicati i medicinali a base di sostanze attive stupefacenti o psicotrope, ivi incluse le sostanze attive ad uso farmaceutico, di corrente impiego terapeutico ad uso umano o veterinario. Nella sezione A della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze analgesiche oppiacee naturali, di semisintesi e di sintesi;
2) i medicinali di cui all'allegato III-bis al presente testo unico;
3) i medicinali contenenti sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di grave dipendenza fisica o psichica;
4) i medicinali contenenti barbiturici che hanno notevole capacità di indurre dipendenza fisica o psichica o entrambe, nonché altre sostanze ad effetto ipnotico-sedativo ad essi assimilabili;
e) nella sezione B della tabella dei medicinali sono indicati:
1) i medicinali che contengono sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica di intensità e gravità minori di quelli prodotti dai medicinali elencati nella sezione A;
2) i medicinali contenenti barbiturici ad azione antiepilettica e quelli contenenti barbiturici con breve durata d'azione;
3) i medicinali contenenti le benzodiazepine, i derivati pirazolopirimidinici ed i loro analoghi ad azione ansiolitica o psicostimolante che possono dar luogo al pericolo di abuso e generare farmacodipendenza;
f) nella sezione C della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze elencate nella tabella dei medicinali, sezione B, da sole o in associazione con altre sostanze attive ad uso farmaceutico, per i quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica;
g) nella sezione D della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze elencate nella tabella dei medicinali, sezioni A o B, da sole o in associazione con altre sostanze attive ad uso farmaceutico quando, per la loro composizione qualitativa e quantitativa e per le modalità del loro uso, presentano rischi di abuso o farmacodipendenza di grado inferiore a quello dei medicinali compresi nella tabella dei medicinali, sezioni A e C, e pertanto non sono assoggettate alla disciplina delle sostanze che entrano a far parte della loro composizione;
2) i medicinali ad uso parenterale a base di benzodiazepine;
3) i medicinali per uso diverso da quello iniettabile, i quali, in associazione con altre sostanze attive ad uso farmaceutico non stupefacenti contengono alcaloidi totali dell'oppio con equivalente ponderale in morfina non superiore allo 0,05 per cento in peso espresso come base anidra; i suddetti medicinali devono essere tali da impedire praticamente il recupero dello stupefacente con facili ed estemporanei procedimenti estrattivi;
4) in considerazione delle prioritarie esigenze terapeutiche nei confronti del dolore severo, composti medicinali utilizzati in terapia del dolore elencati nell'allegato III-bis, limitatamente alle forme farmaceutiche diverse da quella parenterale;
h) nella sezione E della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze elencate nella tabella dei medicinali, sezioni A o B, da sole o in associazione con altre sostanze attive ad uso farmaceutico, quando, per la loro composizione qualitativa e quantitativa o per le modalità del loro uso, possono dar luogo a pericolo di abuso o generare farmacodipendenza di grado inferiore a quello dei medicinali elencati nella tabella dei medicinali, sezioni A, B, C o D;
2) nelle tabelle di cui al comma 1 sono compresi, ai fini dell'applicazione del presente testo unico, tutti gli isomeri, gli esteri, gli eteri, ed i sali anche relativi agli isomeri, esteri ed eteri, nonché gli stereoisomeri nei casi in cui possono essere prodotti, relativi alle sostanze incluse nelle tabelle I, II, e III, e ai medicinali inclusi nella tabella dei medicinali, salvo sia fatta espressa eccezione;
3) le sostanze incluse nelle tabelle sono indicate con la denominazione comune internazionale, il nome chimico, la denominazione comune italiana o l'acronimo, se esiste. È, tuttavia, ritenuto sufficiente, ai fini dell'applicazione del presente testo unico, che nelle tabelle la sostanza sia indicata con almeno una delle denominazioni sopra indicate, purché idonea ad identificarla;
4) le sostanze e le piante di cui al comma 1, lettera a), sono soggette alla disciplina del presente testo unico anche ove si presentino sotto ogni forma di prodotto, miscuglio o miscela;
5) la tabella I contiene, nella sezione B, le sostanze già tabellarmente classificate a decorrere dal 27 febbraio 2006;
6) la tabella dei medicinali indica la classificazione ai fini della fornitura. Sono comunque fatte salve le condizioni stabilite dall'Agenzia italiana del farmaco all'atto del rilascio dell'autorizzazione all'immissione in commercio, nonché le limitazioni e i divieti stabiliti dal Ministero della salute per esigenze di salute pubblica.
* 1. 2. Laffranco, Chiarelli, Fabrizio Di Stefano, Bianconi.
Sostituire il comma 3 con il seguente:
3. L'articolo 14 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 14. – (Criteri per la formazione delle tabelle). – 1. La inclusione delle sostanze stupefacenti o psicotrope nelle tabelle di cui all'articolo 13 è effettuata in base ai seguenti criteri:
a) nella tabella I devono essere indicati:
1) l'oppio e i materiali da cui possono essere ottenute le sostanze oppiacee naturali, estraibili dal papavero sonnifero; gli alcaloidi ad azione narcotico-analgesica da esso estraibili; le sostanze ottenute per trasformazione chimica di quelle prima indicate; le sostanze ottenibili per sintesi che siano riconducibili, per struttura chimica o per effetti, a quelle oppiacee precedentemente indicate; eventuali intermedi per la loro sintesi;
2) le foglie di coca e gli alcaloidi ad azione eccitante sul sistema nervoso centrale da queste estraibili; le sostanze ad azione analoga ottenute per trasformazione chimica degli alcaloidi sopra indicati oppure per sintesi;
3) le sostanze di tipo amfetaminico ad azione eccitante sul sistema nervoso centrale;
4) ogni altra sostanza che produca effetti sul sistema nervoso centrale ed abbia capacità di determinare dipendenza fisica o psichica dello stesso ordine o di ordine superiore a quelle precedentemente indicate;
5) gli indolici, siano essi derivati triptaminici che lisergici, e i derivati feniletilamminici, che abbiano effetti allucinogeni o che possano provocare distorsioni sensoriali;
6) i tetraidrocannabinoli, i loro analoghi, le sostanze ottenute per sintesi o semisintesi che siano ad essi riconducibili per struttura chimica o per effetto farmaco-tossicologico;
7) ogni altra pianta o sostanza naturale o sintetica che possa provocare allucinazioni o gravi distorsioni sensoriali e tutte le sostanze ottenute per estrazione o per sintesi chimica che provocano la stessa tipologia di effetti a carico del sistema nervoso centrale;
8) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera d);
9) la cannabis indica e i prodotti da essa ottenuti;
10) le preparazioni contenenti cannabis indica, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera d);
b) nella tabella II devono essere indicati:
1) i barbiturici che hanno notevole capacità di indurre dipendenza fisica o psichica o entrambe, nonché altre sostanze ad effetto ipnotico-sedativo ad essi assimilabili. Sono pertanto esclusi i barbiturici a lunga durata e di accertato effetto antiepilettico e i barbiturici a breve durata di impiego quali anestetici generali, sempre che tutte le dette sostanze non comportino i pericoli di dipendenza innanzi indicati;
2) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera d);
c) nella tabella III devono essere indicate:
1) le sostanze per le quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica di intensità e gravità minori di quelli prodotti dalle sostanze elencate nelle tabelle I e II;
2) le preparazioni contenenti le sostanze di cui alla presente lettera, in conformità alle modalità indicate nella tabella dei medicinali di cui alla lettera d);
d) nella tabella denominata «tabella dei medicinali» e suddivisa in cinque sezioni, sono indicati i medicinali a base di sostanze attive stupefacenti o psicotrope, ivi incluse le sostanze attive ad uso farmaceutico, di corrente impiego terapeutico ad uso umano o veterinario. Nella sezione A della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze analgesiche oppiacee naturali, di semisintesi e di sintesi;
2) i medicinali di cui all'allegato III-bis al presente testo unico;
3) i medicinali contenenti sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di grave dipendenza fisica o psichica;
4) i medicinali contenenti barbiturici che hanno notevole capacità di indurre dipendenza fisica o psichica o entrambe, nonché altre sostanze ad effetto ipnotico-sedativo ad essi assimilabili;
e) nella sezione B della tabella dei medicinali sono indicati:
1) i medicinali che contengono sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica di intensità e gravità minori di quelli prodotti dai medicinali elencati nella sezione A;
2) i medicinali contenenti barbiturici ad azione antiepilettica e quelli contenenti barbiturici con breve durata d'azione;
3) i medicinali contenenti le benzodiazepine, i derivati pirazolopirimidinici ed i loro analoghi ad azione ansiolitica o psicostimolante che possono dar luogo al pericolo di abuso e generare farmacodipendenza;
f) nella sezione C della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze elencate nella tabella dei medicinali, sezione B, da sole o in associazione con altre sostanze attive ad uso farmaceutico, per i quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica;
g) nella sezione D della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze elencate nella tabella dei medicinali, sezioni A o B, da sole o in associazione con altre sostanze attive ad uso farmaceutico quando, per la loro composizione qualitativa e quantitativa e per le modalità del loro uso, presentano rischi di abuso o farmacodipendenza di grado inferiore a quello dei medicinali compresi nella tabella dei medicinali, sezioni A e C, e pertanto non sono assoggettate alla disciplina delle sostanze che entrano a far parte della loro composizione;
2) i medicinali ad uso parenterale a base di benzodiazepine;
3) i medicinali per uso diverso da quello iniettabile, i quali, in associazione con altre sostanze attive ad uso farmaceutico non stupefacenti contengono alcaloidi totali dell'oppio con equivalente ponderale in morfina non superiore allo 0,05 per cento in peso espresso come base anidra; i suddetti medicinali devono essere tali da impedire praticamente il recupero dello stupefacente con facili ed estemporanei procedimenti estrattivi;
4) in considerazione delle prioritarie esigenze terapeutiche nei confronti del dolore severo, composti medicinali utilizzati in terapia del dolore elencati nell'allegato III-bis, limitatamente alle forme farmaceutiche diverse da quella parenterale;
h) nella sezione E della tabella dei medicinali sono indicati:
1) i medicinali contenenti le sostanze elencate nella tabella dei medicinali, sezioni A o B, da sole o in associazione con altre sostanze attive ad uso farmaceutico, quando, per la loro composizione qualitativa e quantitativa o per le modalità del loro uso, possono dar luogo a pericolo di abuso o generare farmacodipendenza di grado inferiore a quello dei medicinali elencati nella tabella dei medicinali, sezioni A, B, C o D;
2) nelle tabelle di cui al comma 1 sono compresi, ai fini dell'applicazione del presente testo unico, tutti gli isomeri, gli esteri, gli eteri, ed i sali anche relativi agli isomeri, esteri ed eteri, nonché gli stereoisomeri nei casi in cui possono essere prodotti, relativi alle sostanze incluse nelle tabelle I, II, e III, e ai medicinali inclusi nella tabella dei medicinali, salvo sia fatta espressa eccezione;
3) le sostanze incluse nelle tabelle sono indicate con la denominazione comune internazionale, il nome chimico, la denominazione comune italiana o l'acronimo, se esiste. È, tuttavia, ritenuto sufficiente, ai fini dell'applicazione del presente testo unico, che nelle tabelle la sostanza sia indicata con almeno una delle denominazioni sopra indicate, purché idonea ad identificarla;
4) le sostanze e le piante di cui al comma 1, lettera a), sono soggette alla disciplina del presente testo unico anche ove si presentino sotto ogni forma di prodotto, miscuglio o miscela;
5) la tabella I contiene, nella sezione B, le sostanze già tabellarmente classificate a decorrere dal 27 febbraio 2006;
6) la tabella dei medicinali indica la classificazione ai fini della fornitura. Sono comunque fatte salve le condizioni stabilite dall'Agenzia italiana del farmaco all'atto del rilascio dell'autorizzazione all'immissione in commercio, nonché le limitazioni e i divieti stabiliti dal Ministero della salute per esigenze di salute pubblica.
*1. 532. Rondini, Molteni.
Al comma 3, capoverso Art. 14, comma 1, lettera a), sostituire il numero 6) con il seguente:
6) la cannabis indica, i prodotti da essa ottenuti; i tetraidrocannabinoli, i loro analoghi naturali, le sostanze ottenute per sintesi o semisintesi che siano ad essi riconducibili per struttura chimica o per effetto farmaco-tossicologico.
Conseguentemente:
al medesimo comma, sopprimere la lettera b);
all'allegato A, inserire la Tabella II nella Tabella I, sezione A.
1. 504. Rondini, Molteni.
Al comma 3, capoverso Art. 14, comma 1, lettera a), sostituire il numero 6) con il seguente:
6) la cannabis indica, i prodotti da essa ottenuti; i tetraidrocannabinoli, i loro analoghi, le sostanze ottenute per sintesi o semisintesi che siano ad essi riconducibili per struttura chimica o per effetto farmaco-tossicologico.
Conseguentemente, al medesimo comma, sopprimere la lettera b).
1. 590. Giorgia Meloni, Rampelli.
Al comma 3, capoverso Art. 14, comma 1, lettera a), sostituire il numero 6) con il seguente:
6) la cannabis indica, i prodotti da essa ottenuti, con percentuale di principio attivo superiore al 2,5 per cento; i tetraidrocannabinoli, i loro analoghi, le sostanze ottenute per sintesi o semisintesi che siano ad essi riconducibili per struttura chimica o per effetto farmaco-tossicologico.
Conseguentemente, al medesimo comma, lettera b), numero 1), dopo la parola: cannabis aggiungere le seguenti: indica con percentuale di principio attivo inferiore al 2,5 per cento.
1. 591. Giorgia Meloni, Rampelli.
Al comma 3, capoverso Art. 14, comma 1, lettera a), numero 6), aggiungere, in fine, le parole:, nonché le resine e gli oli estratti dalla cannabis e le foglie, infiorescenze e brattee di cannabis che abbiano un contenuto medio di tetraidrocannabinolo superiore al 20 per cento.
*1. 103. Gigli, Binetti.
Al comma 3, capoverso Art. 14, comma 1, lettera a), numero 6), aggiungere, in fine, le parole:, nonché le resine e gli oli estratti dalla cannabis e le foglie, infiorescenze e brattee di cannabis che abbiano un contenuto medio di tetraidrocannabinolo superiore al 20 per cento.
*1. 104. Pagano, Roccella, Calabrò.
Al comma 3, capoverso Art. 14, comma 1, lettera a), numero 6), aggiungere, in fine, le parole:, nonché le parti vegetali della cannabis oltre che le resine e gli oli da essa estratti che abbiano un contenuto medio di tetraidrocannabinolo superiore al 20 per cento.
**1. 105. Pagano, Roccella, Calabrò.
Al comma 3, capoverso Art. 14, comma 1, lettera a), numero 6), aggiungere, in fine, le parole:, nonché le parti vegetali della cannabis oltre che le resine e gli oli da essa estratti che abbiano un contenuto medio di tetraidrocannabinolo superiore al 20 per cento.
**1. 106. Binetti, Gigli.
Al comma 3, capoverso Art. 14, comma 1, lettera a), numero 7), dopo le parole: sistema nervoso centrale aggiungere le seguenti:, ad esclusione dei prodotti derivanti dalla cannabis.
*1. 26. Mantero, Cecconi, Baroni, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Lorefice.
Al comma 3, capoverso Art. 14, comma 1, lettera a), numero 7), dopo le parole: sistema nervoso centrale aggiungere le seguenti:, ad esclusione dei prodotti derivanti dalla cannabis.
*1. 515. Nicchi, Piazzoni, Aiello, Daniele Farina, Sannicandro, Paglia.
Al comma 3, capoverso Art. 14, comma 1, lettera c), numero 1), sopprimere la parola: notevole.
**1. 27. Cecconi, Baroni, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Lorefice, Mantero.
Al comma 3, capoverso Art. 14, comma 1, lettera c), numero 1), sopprimere la parola: notevole.
**1. 579. Chiarelli.
Al comma 3, capoverso Art. 14, comma 1, lettera d), numero 1), sopprimere le parole: di induzione di dipendenza fisica o psichica di intensità e gravità.
1. 28. Lorefice, Cecconi, Baroni, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Mantero.
Al comma 3, capoverso Art. 14, comma 1, lettera d), numero 1), sopprimere la parola: minori.
1. 580. Chiarelli.
Dopo il comma 3, aggiungere il seguente:
3.1. All'articolo 17, comma 1, del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, dopo la parola «Chiunque» sono aggiunte le seguenti: «, salvo quanto previsto al comma 1, secondo e terzo periodo, dell'articolo 26,».
Conseguentemente:
al comma 4, capoverso comma 1, aggiungere, in fine, i seguenti periodi: È inoltre fatta salva la coltivazione per uso personale di cannabis indica fino al numero massimo di cinque piante di sesso femminile. Nel caso la stessa, nei limiti previsti dal periodo precedente, sia messa in atto da un minore, si applica il comma 2-bis dell'articolo 75.
al comma 24-ter, alla lettera a), premettere la seguente:
0a) al comma 1, dopo la parola: «Chiunque», sono aggiunte le seguenti: «, salvo quanto previsto al comma 1, secondo e terzo periodo, dell'articolo 26,»;
al comma 24-quater, dopo la lettera b), aggiungere la seguente:
c) dopo il comma 2, è aggiunto il seguente:
«2-bis. Nei casi di cui al terzo periodo del comma 1 dell'articolo 26, il minore è invitato a seguire il programma terapeutico o altro programma educativo e informativo personalizzato in relazione alle proprie specifiche esigenze, predisposto dal servizio pubblico per le dipendenze competente per territorio o da una struttura privata autorizzata ai sensi dell'articolo 116.»
1. 107. Daniele Farina, Migliore, Sannicandro, Nicchi, Aiello, Piazzoni, Paglia, Zaccagnini.
Dopo il comma 3, aggiungere il seguente:
3.1. All'articolo 17, comma 1, del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono aggiunte, in fine, le parole: «, salvo quanto previsto dai commi 3 e 4 dell'articolo 26,».
Conseguentemente:
dopo il comma 4, aggiungere il seguente:
4-bis. All'articolo 26 del testo unico delle leggi in materia di stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, sono aggiunti, in fine, i seguenti commi:
«3. Non è punibile la coltivazione domiciliare di cannabis per uso personale, consentita al maggiorenne nel limite di 4 piante femmine e la detenzione domiciliare di cannabis per uso personale nel luogo di coltivazione. Non è punibile altresì la detenzione per uso personale di cannabis fuori dal luogo di coltivazione di una quantità non superiore ai 5 grammi lordi.
4. Fuori dal luogo di coltivazione è consentito detenere quantità maggiori di cannabis, previa prescrizione medica e nella misura indicata dalla prescrizione stessa, che il detentore deve sempre portare con sé in originale, assieme ad un valido documento di identità. Nella prescrizione il medico deve indicare le generalità del soggetto abilitato alla detenzione della sostanza, la patologia per la quale si rende necessaria la terapia a base di THC, i motivi che rendono necessaria la detenzione fuori dal luogo di coltivazione di una quantità di sostanza eccedente i limiti fissati al comma 3. In assenza delle indicazioni sopra indicate nella prescrizione, o della stessa prescrizione, si applica il comma 3.»;
al comma 24-ter, alla lettera a), premettere la seguente:
0a) al comma 1, dopo la parola: «Chiunque», sono aggiunte le seguenti: «, salvo quanto previsto dai commi 3 e 4 dell'articolo 26,».
1. 537. Ferraresi, Turco, Paolo Bernini, Agostinelli, Bonafede, Businarolo, Colletti, Sarti.
Al comma 4, capoverso comma 1, aggiungere, in fine, le parole: e fermo restando quanto previsto dal comma 3-bis dell'articolo 73.
Conseguentemente:
al comma 24-ter:
alla lettera a), premettere la seguente:
0a) dopo il comma 3 è aggiunto il seguente:
«3-bis. Non sono punibili la coltivazione per uso personale di cannabis indica fino al numero massimo di cinque piante di sesso femminile e la cessione a terzi di piccoli quantitativi destinati al consumo immediato, salvo che il destinatario sia un minore o che per modalità di presentazione, o in relazione al confezionamento frazionato, alla cessione onerosa, ovvero per altre circostanze dell'azione, si configurino le condotte illecite di cui al comma 5 del presente articolo. Se la coltivazione, nei limiti previsti dal presente comma, è messa in atto da un minore, si applica il comma 2-bis dell'articolo 75.»;
lettera a), capoverso comma 5, aggiungere, in fine, il seguente periodo: Se le attività illecite hanno ad oggetto le sostanze di cui all'articolo 14, comma 1, lettera b), si applica la pena della reclusione da sei mesi a due anni e la multa fino a 3.000 euro.;
al comma 24-quater:
lettera a), dopo la parola: acquista aggiungere la seguente:, coltiva e sostituire le parole: nelle tabelle II e IV previste con le seguenti: nella tabella IV prevista;
dopo la lettera b), aggiungere la seguente:
c) dopo il comma 2, è aggiunto il seguente:
«2-bis. Nei casi di cui al secondo periodo del comma 3-bis dell'articolo 73, il minore è invitato a seguire il programma terapeutico o altro programma educativo e informativo personalizzato in relazione alle proprie specifiche esigenze, predisposto dal servizio pubblico per le dipendenze competente per territorio o da una struttura privata autorizzata ai sensi dell'articolo 116.».
1. 108. Daniele Farina, Migliore, Sannicandro, Nicchi, Aiello, Piazzoni, Paglia, Zaccagnini.
Al comma 4, capoverso comma 1, aggiungere, in fine, le parole:, nonché con esclusione della coltivazione della cannabis indica, la cui produzione è finalizzata a soddisfare il fabbisogno nazionale di preparati medicinali e per uso terapeutico. A tal fine, con decreto del Presidente della Repubblica da emanare entro sei mesi dalla data di entrata in vigore della presente disposizione, previa deliberazione del Consiglio dei ministri, su proposta del Ministro della salute, di concerto con il Ministro delle politiche agricole alimentari e forestali, sono disciplinati i criteri e le modalità per l'individuazione nel territorio nazionale di aree idonee alla suddetta coltivazione, e, previo parere dell'Agenzia italiana del farmaco (AIFA), sono disciplinati altresì i requisiti degli stabilimenti farmaceutici pubblici e privati abilitati alla acquisizione e alla lavorazione dei prodotti delle suddette coltivazioni, ai fini dello sviluppo dei prodotti medicinali da sottoporre all'esame dell'AIFA secondo le normative vigenti in materia di registrazione.
1. 109. Nicchi, Piazzoni, Daniele Farina.
Al comma 13, capoverso Art. 43, comma 2, sopprimere le parole: per una cura di durata non superiore a trenta giorni.
1. 47. Di Lello.
Al comma 13, capoverso Art. 43, comma 2, dopo le parole: non superiore a trenta giorni aggiungere le seguenti:, anche in regime di convenzione.
* 1. 30. Dall'Osso, Cecconi, Baroni, Di Vita, Silvia Giordano, Grillo, Lorefice, Mantero.
Al comma 13, capoverso Art. 43, comma 2, dopo le parole: non superiore a trenta giorni aggiungere le seguenti:, anche in regime di convenzione.
* 1. 581. Chiarelli.
Al comma 13, capoverso Art. 43, comma 4-bis, primo periodo, dopo le parole: pazienti affetti da dolore severo aggiungere le seguenti: e da dipendenza da oppiacei.
1. 31. Di Vita, Cecconi, Baroni, Dall'Osso, Silvia Giordano, Grillo, Lorefice, Mantero.
Al comma 13, capoverso Art. 43, comma 5, secondo periodo, sopprimere le parole: in affidamento.
1. 34. Silvia Giordano, Cecconi, Baroni, Dall'Osso, Di Vita, Grillo, Lorefice, Mantero.
Al comma 13, capoverso Art. 43, comma 5-bis, aggiungere, in fine, le parole:, da emanarsi entro trenta giorni dalla data di entrata in vigore della legge di conversione del presente decreto.
1. 110. Nicchi, Piazzoni, Aiello, Daniele Farina, Sannicandro, Paglia.
Al comma 18, capoverso Art. 60, sostituire il comma 5 con il seguente:
5. Le movimentazioni delle sostanze e dei medicinali di cui alle tabelle previste dall'articolo 14 sono registrate, entro il 31 dicembre 2015, esclusivamente su supporto informatico, con le modalità stabilite dal decreto del Ministro della salute 11 maggio 2010.
1. 100. Mantero, Cecconi, Baroni, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Lorefice.
Al comma 22, capoverso comma 1, sostituire le parole: annualmente non oltre il 31 gennaio di ciascun anno con le seguenti: trimestralmente, esclusivamente su supporto informatico certificato con le modalità di cui al decreto del Ministro della salute 11 maggio 2010.
1. 36. Baroni, Cecconi, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Lorefice, Mantero.
Dopo il comma 23, aggiungere il seguente:
23-bis. L'articolo 68 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, è sostituito dal seguente:
«Art. 68. – 1. Salvo che il fatto costituisca più grave reato, chiunque non ottemperi alle norme sulla tenuta dei registri di entrata e uscita, di carico e scarico e di lavorazione, nonché all'obbligo di trasmissione dei dati e di denunzia di cui agli articoli da 60 a 67 è punito con l'arresto sino a due anni o con l'ammenda da euro tremila a euro trentamila.
2. Qualora le irregolarità riscontrate siano relative a violazioni della normativa regolamentare sulla tenuta dei registri di cui al comma 1, si applica la sanzione amministrativa del pagamento di una somma da euro mille a euro tremila.»
1. 45. Dall'Osso, Baroni, Cecconi, Di Vita, Silvia Giordano, Grillo, Lorefice, Mantero.
Sopprimere il comma 24-bis.
1. 200. Rondini.
Sopprimere il comma 24-ter.
1. 201. Molteni.
Sostituire il comma 24-ter con il seguente:
24-ter. L'articolo 73 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, e successive modificazioni, è sostituito dal seguente:
«1 Chiunque, senza l'autorizzazione di cui all'articolo 17, coltiva, produce, fabbrica, estrae, raffina, vende, offre o mette in vendita, cede, distribuisce, commercia, trasporta, procura ad altri, invia, passa o spedisce in transito, consegna per qualsiasi scopo sostanze stupefacenti o psicotrope di cui alle tabelle previste dall'articolo 14 è punito con la reclusione da sei a venti anni e con la multa da euro 26.000 a euro 260.000.
2. Con le medesime pene di cui al comma 1 è punito chiunque, senza l'autorizzazione di cui all'articolo 17, importa, esporta, acquista, riceve a qualsiasi titolo o comunque detiene sostanze stupefacenti o psicotrope che per quantità, in particolare se superiore ai limiti massimi indicati con decreto del Ministro della salute, emanato di concerto col Ministro della giustizia, sentito il Dipartimento nazionale per le politiche antidroga della Presidenza del Consiglio dei ministri, ovvero per modalità di presentazione, avuto riguardo al peso lordo complessivo o al confezionamento frazionato, ovvero per altre circostanze dell'azione, appaiono destinate a un uso non esclusivamente personale.
2-bis. Se le condotte di cui ai commi precedenti riguardano le sostanze di cui alla tabella II, le pene sono quella della reclusione da tre a dieci anni e della multa da 10.000 a 100.000 euro.
3. Chiunque, essendo munito dell'autorizzazione di cui all'articolo 17, illecitamente cede, mette o procura che altri metta in commercio le sostanze o le preparazioni indicate nelle tabelle di cui all'articolo 14, ovvero produce o commercializza le sostanze chimiche di base e i precursori di cui alle categorie 1, 2 e 3 dell'allegato I al presente testo unico, utilizzabili nella produzione clandestina delle sostanze stupefacenti di cui alle tabelle dell'articolo 14, è punito con la reclusione da sei a ventidue anni e con la multa da euro 26.000 a euro 300.000.
4. Le stesse pene si applicano a chiunque coltiva, produce o fabbrica sostanze stupefacenti o psicotrope diverse da quelle stabilite nel decreto di autorizzazione.
5. Quando, per i mezzi, la modalità o le circostanze dell'azione ovvero per la qualità e quantità delle sostanze, i falli previsti nel presente articolo sono di lieve entità, si applicano le pene della reclusione da uno a sei anni e della multa da euro 3.000 a euro 26.000. Se tali condotte riguardano le sostanze di cui alla tabella II, le pene sono quella della reclusione da sei mesi a tre anni e della multa da 1.000 a 10.000 euro.
6. Nell'ipotesi di cui al comma precedente, limitatamente ai reati di cui al presente articolo commessi da persona tossicodipendente o da assuntore di sostanze stupefacenti o psicotrope, il giudice, con la sentenza di condanna o di applicazione della pena su richiesta delle parti, su richiesta dell'imputato e sentito il pubblico ministero, qualora non debba concedersi il beneficio della sospensione condizionale della pena, può applicare, anziché le pene detentive e pecuniarie, quella del lavoro di pubblica utilità di cui all'ad. 54 del decreto legislativo n. 274 del 2000, secondo le modalità ivi previste. Con la sentenza il giudice incarica l'ufficio locale di esecuzione penale esterna di verificare l'effettivo svolgimento del lavoro di pubblica utilità. In deroga a quanto disposto dall'articolo 54 del decreto legislativo n. 274 del 2000, il lavoro di pubblica utilità ha una durata corrispondente a quella della sanzione detentiva irrogata. Esso può anche essere disposto nelle strutture private autorizzate ai sensi dell'articolo 116, previo consenso delle stesse. In caso di violazione degli obblighi connessi allo svolgimento del lavoro di pubblica utilità, in deroga a quanto disposto dall'articolo 54 del decreto legislativo n. 274 del 2000, su richiesta del pubblico ministero o d'ufficio, il giudice che procede, o quello della esecuzione, ai sensi dell'articolo 666 cod. proc. penale, dispone la revoca della pena con conseguente ripristino di quella sostituita. Avverso la revoca è ammesso ricorso per cassazione, non sospensivo della revoca stessa. Il lavoro di pubblica utilità può sostituire la pena per non più di due volte.
7. La disposizione di cui al comma precedente si applica anche nell'ipotesi di reato diverso da quelli di cui al comma 5, commesso, per una sola volta, da persona tossicodipendente o da assuntore abituale di sostanze stupefacenti o psicotrope e in relazione a tale propria condizione, per il quale il giudice infligga una pena non superiore a un anno di detenzione, salvo che si tratti di reato previsto dall'ad. 407, comma 2 lettera a) del cod. proc. penale o reato contro la persona.
8. Se il fatto è commesso da tre o più persone in concorso fra loro la pena è aumentata.
9. Le pene previste nel presente articolo sono diminuite dalla metà ai due terzi per chi si adopera per evitare che l'attività delittuosa sia portata a conseguenze ulteriori, anche aiutando concretamente l'autorità di polizia o l'autorità giudiziaria nella sottrazione di risorse rilevanti per la commissione dei delitti.
1. 209. Giorgia Meloni, Rampelli.
Sostituire il comma 24-ter con il seguente:
24-ter. L'articolo 73 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, e successive modificazioni, è sostituito dal seguente:
«1. Chiunque, senza l'autorizzazione di cui all'articolo 17, coltiva, produce, fabbrica, estrae, raffina, vende, offre o mette in vendita, cede, distribuisce, commercia, trasporta, procura ad altri, invia, passa o spedisce in transito, consegna per qualsiasi scopo sostanze stupefacenti o psicotrope di cui alle tabelle previste dall'articolo 14 è punito con la reclusione da sei a venti anni e con la multa da euro 26.000 a euro 260.000.
2. Con le medesime pene di cui al comma 1 è punito chiunque, senza l'autorizzazione di cui all'articolo 17, importa, esporta, acquista, riceve a qualsiasi titolo o comunque detiene sostanze stupefacenti o psicotrope che per quantità, in particolare se superiore ai limiti massimi indicati con decreto del Ministro della salute, emanato di concerto col Ministro della giustizia, sentito il Dipartimento nazionale per le politiche antidroga della Presidenza del Consiglio dei ministri, ovvero per modalità di presentazione, avuto riguardo al peso lordo complessivo o al confezionamento frazionato, ovvero per altre circostanze dell'azione, appaiono destinate a un uso non esclusivamente personale.
3. Chiunque, essendo munito dell'autorizzazione di cui all'articolo 17, illecitamente cede, mette o procura che altri metta in commercio le sostanze o le preparazioni indicate nelle tabelle di cui all'articolo 14, ovvero produce o commercializza le sostanze chimiche di base e i precursori di cui alle categorie 1, 2 e 3 dell'allegato I al presente testo unico, utilizzabili nella produzione clandestina delle sostanze stupefacenti di cui alle tabelle dell'articolo 14, è punito con la reclusione da sei a ventidue anni e con la multa da euro 26.000 a euro 300.000.
4. Le stesse pene si applicano a chiunque coltiva, produce o fabbrica sostanze stupefacenti o psicotrope diverse da quelle stabilite nel decreto di autorizzazione.
5. Quando, per i mezzi, la modalità o le circostanze dell'azione ovvero per la qualità e quantità delle sostanze, i fatti previsti nel presente articolo sono di lieve entità, si applicano le pene della reclusione da uno a sei anni e della multa da euro 3.000 a euro 26.000.
6. Nell'ipotesi di cui al comma precedente, limitatamente ai reati di cui al presente articolo commessi da persona tossicodipendente o da assuntore di sostanze stupefacenti o psicotrope, il giudice, con la sentenza di condanna o di applicazione della pena su richiesta delle parti, su richiesta dell'imputato e sentito il pubblico ministero, qualora non debba concedersi il beneficio della sospensione condizionale della pena, può applicare, anziché le pene detentive e pecuniarie, quella del lavoro di pubblica utilità di cui all'articolo 54 del decreto legislativo n. 274 del 2000, secondo le modalità ivi previste. Con la sentenza il giudice incarica l'ufficio locale di esecuzione penale esterna di verificare l'effettivo svolgimento del lavoro di pubblica utilità. In deroga a quanto disposto dall'articolo 54 del decreto legislativo n. 274 del 2000, il lavoro di pubblica utilità ha una durata corrispondente a quella della sanzione detentiva irrogata. Esso può anche essere disposto nelle strutture private autorizzate ai sensi dell'articolo 116, previo consenso delle stesse. In caso di violazione degli obblighi connessi allo svolgimento del lavoro di pubblica utilità, in deroga a quanto disposto dall'articolo 54 del decreto legislativo n. 274 del 2000, su richiesta del pubblico ministero o d'ufficio, il giudice che procede, o quello della esecuzione, ai sensi dell'articolo 666 cod. proc. penale, dispone la revoca della pena con conseguente ripristino di quella sostituita. Avverso la revoca è ammesso ricorso per cassazione, non sospensivo della revoca stessa. Il lavoro di pubblica utilità può sostituire la pena per non più di due volte.
7. La disposizione di cui al comma precedente si applica anche nell'ipotesi di reato diverso da quelli di cui al comma 5, commesso, per una sola volta, da persona tossicodipendente o da assuntore abituale di sostanze stupefacenti o psicotrope e in relazione a tale propria condizione, per il quale il giudice infligga una pena non superiore a un anno di detenzione, salvo che si tratti di reato previsto dall'articolo 407, comma 2 lettera a) del cod. proc. penale o reato contro la persona.
8. Se il fatto è commesso da tre o più persone in concorso fra loro la pena è aumentata.
9. Le pene previste nel presente articolo sono diminuite dalla metà ai due terzi per chi si adopera per evitare che l'attività delittuosa sia portata a conseguenze ulteriori, anche aiutando concretamente l'autorità di polizia o l'autorità giudiziaria nella sottrazione di risorse rilevanti per la commissione dei delitti.
1. 210. Giorgia Meloni, Rampelli.
Al comma 24-ter sostituire le lettere a) e b) con le seguenti:
a) il comma 1 è sostituito dal seguente:
«1. Chiunque, senza l'autorizzazione di cui all'articolo 17, coltiva, produce, fabbrica, estrae, raffina, vende, offre o mette in vendita, cede, distribuisce, commerci, trasporta, procura ad altri, invia, passa o spedisce in transito, consegna per qualunque scopo sostanze stupefacenti o psicotrope di cui alla tabella I prevista dall'articolo 14, è punito con la reclusione da sei a venti anni e con la multa da euro 26.000 a euro 260.000»;
b) dopo il comma 1 è inserito il seguente:
«1-bis. Con le medesime pene di cui al comma 1 è punito chiunque, senza l'autorizzazione di cui all'articolo 17, importa, esporta, acquista, riceve a qualsiasi titolo o comunque illecitamente detiene:
a) sostanze stupefacenti o psicotrope che per quantità, in particolare se superiore ai limiti massimi indicati con decreto del Ministro della salute emanato di concerto con il Ministro della giustizia sentita la Presidenza del Consiglio dei Ministri – Dipartimento nazionale per le politiche antidroga, ovvero per modalità di presentazione, avuto riguardo al peso lordo complessivo o al confezionamento frazionato, ovvero per altre circostanze dell'azione, appaiono destinate ad un uso non esclusivamente personale;
b) medicinali contenenti sostanze stupefacenti o psicotrope elencate nella tabella II, sezione A, che eccedono il quantitativo prescritto. In questa ultima ipotesi, le pene suddette sono diminuite da un terzo alla metà»;
c) il comma 2 è sostituito dal seguente: «Chiunque, essendo munito dell'autorizzazione di cui all'articolo 17, illecitamente cede, mette o procura che altri metta in commercio le sostanze o le preparazioni indicate nelle tabelle le II di cui all'articolo 14, è punito con la reclusione da sei a ventidue anni e con la multa da euro 26.000 a euro 300.000»;
d) dopo il comma 2 è inserito il seguente:
2-bis. Le pene di cui al comma 2 si applicano anche nel caso di illecita produzione o commercializzazione delle sostanze chimiche di base e dei precursori di cui alle categorie 1, 2 e 3 dell'allegato I al presente testo unico, utilizzabili nella produzione clandestina delle sostanze stupefacenti o psicotrope previste nelle tabelle di cui all'articolo 14;
e) i commi 3, 4 e 5 sono sostituiti dai seguenti:
«3. Le stesse pene si applicano a chiunque coltiva, produce o fabbrica sostanze stupefacenti o psicotrope diverse da quelle stabilite nel decreto di autorizzazione.
4. Quando le condotte di cui al comma 1 riguardano i medicinali ricompresi nella tabella II, sezioni A, B e C, di cui all'articolo 14 e non ricorrono le condizioni di cui all'articolo 17, si applicano le pene ivi stabilite, diminuite da un terzo alla metà.
5. Quando, per i mezzi, per la modalità o le circostanze dell'azione ovvero per la qualità e quantità delle sostanze, i fatti previsti dal presente articolo sono di lieve entità, si applicano le pene della reclusione da uno a sei anni e della multa da euro 3.000 a euro 26.000»;
f) dopo il comma 5 è inserito il seguente:
«5-bis. Nell'ipotesi di cui al comma 5, limitatamente ai reati di cui al presente articolo commessi da persona tossicodipendente o da assuntore di sostanze stupefacenti o psicotrope, il giudice, con la sentenza di condanna o di applicazione della pena su richiesta delle parti a norma dell'articolo 444 del codice di procedura penale, su richiesta dell'imputato e sentito il pubblico ministero, qualora non debba concedersi il beneficio della sospensione condizionale della pena, può applicare, anziché le pene detentive e pecuniarie, quella del lavoro di pubblica utilità di cui all'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, secondo le modalità ivi previste. Con la sentenza il giudice incarica l'Ufficio locale di esecuzione penale esterna di verificare l'effettivo svolgimento del lavoro di pubblica utilità. L'Ufficio riferisce periodicamente al giudice. In deroga a quanto disposto dall'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, il lavoro di pubblica utilità ha una durata corrispondente a quella della sanzione detentiva irrogata. Esso può essere disposto anche nelle strutture private autorizzate ai sensi dell'articolo 116, previo consenso delle stesse. In caso di violazione degli obblighi connessi allo svolgimento del lavoro di pubblica utilità, in deroga a quanto previsto dall'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, su richiesta del pubblico ministero o d'ufficio, il giudice che procede, o quello dell'esecuzione, con le formalità di cui all'articolo 666 del codice di procedura penale, tenuto conto dell'entità dei motivi e delle circostanze della violazione, dispone la revoca della pena con conseguente ripristino di quella sostituita. Avverso tale provvedimento di revoca è ammesso ricorso per Cassazione, che non ha effetto sospensivo. Il lavoro di pubblica utilità può sostituire la pena per non più di due volte.»
g) la rubrica è sostituita dalla seguente: «Produzione, traffico e detenzione illeciti di sostanze stupefacenti o psicotrope»;
1. 229. Chiarelli.
Al comma 24-ter, alla lettera a), premettere la seguente:
0a) dopo il comma 3 è inserito il seguente:
«3-bis. Non sono punibili la coltivazione per uso personale di cannabis indica fino al numero massimo di cinque piante di sesso femminile e la cessione a terzi di piccoli quantitativi destinati al consumo immediato, salvo che il destinatario sia un minore o che per modalità di presentazione, o in relazione al confezionamento frazionato, alla cessione onerosa, ovvero per altre circostanze dell'azione, si configurino le condotte illecite di cui al comma 5 del presente articolo. Se la coltivazione, nei limiti previsti dal presente comma, è messa in atto da un minore, si applica il comma 2-bis dell'articolo 75».
Conseguentemente, al comma 24-quater, dopo la lettera b), aggiungere la seguente:
b-bis. dopo il comma 2 è inserito il seguente:
2-bis. Nei casi di cui al secondo periodo del comma 3-bis dell'articolo 73, il minore è invitato a seguire il programma terapeutico o altro programma educativo e informativo personalizzato in relazione alle proprie specifiche esigenze, predisposto dal servizio pubblico per le dipendenze competente per territorio o da una struttura privata autorizzata ai sensi dell'articolo 116».
1. 223. Daniele Farina, Migliore, Sannicandro, Nicchi, Aiello, Piazzoni, Paglia, Zaccagnini.
Al comma 24-ter, alla lettera a), premettere la seguente:
0a) al comma 4 sono premesse le parole: «Salvo che siano finalizzati al consumo personale».
Conseguentemente, al comma 24-quater, lettera a) sostituire il capoverso con il seguente: «Chiunque, per farne uso personale, illecitamente importa, esporta, acquista, coltiva, riceve a qualsiasi titolo o comunque detiene sostanze stupefacenti o psicotrope di cui alle tabelle I e III previste dall'articolo 14, è sottoposto, per un periodo non inferiore a due mesi e non superiore a un anno, a una o più delle seguenti sanzioni amministrative».
1. 233. Ferraresi, Turco, Paolo Bernini, Agostinelli, Bonafede, Businarolo, Colletti, Sarti.
Al comma 24-ter, alla lettera a), premettere la seguente:
0a) al comma 4 sono premesse le parole: «Salvo che siano finalizzati al consumo personale».
Conseguentemente, al comma 24-quater, lettera a), sostituire il capoverso con il seguente: «Chiunque illecitamente importa, esporta, acquista, coltiva, riceve a qualsiasi titolo o comunque detiene per farne uso personale sostanze stupefacenti o psicotrope di cui alle tabelle I e III previste dall'articolo 14, è sottoposto, per un periodo non inferiore a due mesi e non superiore a un anno, a una o più delle seguenti sanzioni amministrative».
1. 232. Turco, Ferraresi, Paolo Bernini, Agostinelli, Bonafede, Businarolo, Colletti, Sarti.
Al comma 24-ter, alla lettera a), premettere la seguente:
0a) al comma 4 sono premesse le parole: «Salvo che siano finalizzati al consumo personale».
1. 230. Turco, Ferraresi, Paolo Bernini, Agostinelli, Bonafede, Businarolo, Colletti, Sarti.
Al comma 24-ter, sopprimere la lettera a).
1. 202. Giorgia Meloni, Rampelli.
Al comma 24-ter, lettera a), sostituire il capoverso con il seguente:
«5. Quando, per i mezzi, per la modalità o le circostanze dell'azione ovvero per la qualità e quantità delle sostanze, i fatti previsti dal presente articolo sono di lieve entità, si applicano le pene della reclusione da uno a sei anni e della multa da euro 3000 a euro 26.000».
1. 503. Rondini, Molteni.
Al comma 24-ter, lettera a), capoverso, dopo le parole: presente articolo aggiungere le seguenti: relativamente alle sostanze di cui alle tabelle I e III previste dall'articolo 14.
Conseguentemente, al medesimo capoverso:
sostituire le parole: sei mesi a quattro anni con le seguenti: uno a cinque anni;
sostituire le parole: euro 1.032 a euro 10.329 con le seguenti: euro 2.064 a euro 20.658.
aggiungere, in fine, le parole: Salvo che il fatto costituisca più grave reato, chiunque commette uno dei fatti previsti dal presente articolo relativamente alle sostanze di cui alle tabelle II e IV previste dall'articolo 14 che, per i mezzi, per la modalità o le circostanze dell'azione ovvero per la qualità e quantità delle sostanze, è di lieve entità, è punito con le pene della reclusione da sei mesi a tre anni e della multa da euro 1.032 a euro 10.329.
1. 216. Ferraresi, Turco, Paolo Bernini, Agostinelli, Bonafede, Businarolo, Colletti, Sarti.
Al comma 24-ter, lettera a), capoverso, dopo le parole: presente articolo aggiungere le seguenti: relativamente alle sostanze di cui alle tabelle I e III previste dall'articolo 14.
Conseguentemente, al medesimo capoverso, aggiungere, in fine, le parole: Salvo che il fatto costituisca più grave reato, chiunque commette uno dei fatti previsti dal presente articolo relativamente alle sostanze di cui alle tabelle II e IV previste dall'articolo 14 che, per i mezzi, per la modalità o le circostanze dell'azione ovvero per la qualità e quantità delle sostanze, è di lieve entità, è punito con le pene della reclusione da tre mesi a tre anni e della multa da euro 516 a euro 5.165.
1. 217. Turco, Ferraresi, Paolo Bernini, Agostinelli, Bonafede, Businarolo, Colletti, Sarti.
Al comma 24-ter, lettera a), capoverso, sostituire le parole da: sei mesi fino alla fine del capoverso con le seguenti: uno a sei anni e della multa da euro 3.000 a euro 26.000.
1. 228. Chiarelli.
Al comma 24-ter, lettera a), capoverso, sostituire le parole da: sei mesi fino alla fine del capoverso con le seguenti: tre mesi a due anni e della multa da euro 516 a euro 5.115.
1. 219. Zaccagnini.
Al comma 24-ter, lettera a), capoverso, sostituire le parole: da sei mesi a quattro anni con le seguenti: da tre mesi a due anni.
1. 218. Zaccagnini.
Al comma 24-ter, lettera a), capoverso, sostituire la parola: quattro con la seguente: sette.
1. 205. Rondini.
Al comma 24-ter, lettera a), capoverso, sostituire la parola: quattro con la seguente: sei.
1. 203. Rondini.
Al comma 24-ter, lettera a), capoverso, sostituire la parola: quattro con le seguenti: cinque anni e sei mesi.
1. 204. Molteni.
Al comma 24-ter, lettera a), capoverso, sostituire le parole: euro 1.032 con le seguenti: euro 6.000.
1. 211. Molteni.
Al comma 24-ter, lettera a), capoverso, sostituire le parole: euro 1.032 con le seguenti: euro 5.000.
1. 207. Molteni.
Al comma 24-ter, lettera a), capoverso, sostituire le parole: euro 1.032 con le seguenti: euro 4.000.
1. 208. Molteni.
Al comma 24-ter, lettera a), capoverso, aggiungere, in fine, le parole: Nel caso specifico che le attività illecite abbiano ad oggetto le sostanze di cui all'articolo 14, comma 1, lettera b) (Tabella II), si applica, al posto della pena detentiva e pecuniaria, quella del lavoro di pubblica utilità di cui all'articolo 54 del decreto legislativo 28 agosto 2000, n. 274, secondo le modalità ivi previste.
Conseguentemente, al medesimo comma, lettera b), capoverso, primo periodo, sostituire le parole: Nell'ipotesi di cui al comma 5 con le seguenti: In tutti gli altri casi previsti dal comma 5, al di fuori delle attività illecite che abbiano ad oggetto le sostanze di cui all'articolo 14, comma 1, lettera b) (Tabella II).
1. 213. Zaccagnini.
Al comma 24-ter, lettera a), capoverso, aggiungere, in fine, le parole: Se le attività illecite hanno ad oggetto le sostanze di cui all'articolo 14, comma 1, lettere a) e c) (Tabella I e III), si applica la pena della reclusione da uno a sei anni e della multa da euro 3.000 a euro 26.000.
1. 225. Chiarelli.
Al comma 24-ter, lettera a), capoverso, aggiungere, in fine, le parole: Se le attività illecite hanno ad oggetto le sostanze di cui all'articolo 14, comma 1, lettere a) e c) (Tabella I e III), si applica la pena della reclusione da uno a cinque anni e della multa da euro 3.000 a euro 26.000.
1. 227. Chiarelli.
Al comma 24-ter, lettera a), capoverso, aggiungere, in fine, le parole: Se le attività illecite hanno ad oggetto le sostanze di cui all'articolo 14, comma 1, lettere a) e c) (Tabella I e III), si applica la pena della reclusione da uno a quattro anni e della multa da euro 3.000 a euro 26.000.
1. 226. Chiarelli.
Al comma 24-ter, lettera a), capoverso, aggiungere, in fine, le parole: Se le attività illecite hanno ad oggetto le sostanze di cui all'articolo 14, comma 1, lettera b) (Tabella II), si applica la pena della reclusione da sei mesi a tre anni e della multa nel limite massimo di euro 3000.
1. 212. Daniele Farina, Migliore, Sannicandro, Nicchi, Aiello, Piazzoni, Paglia.
Al comma 24-ter, lettera a), capoverso, aggiungere, in fine, le parole: Se le attività illecite hanno ad oggetto le sostanze di cui all'articolo 14, comma 1, lettera b) (Tabella II), si applica la pena della reclusione da sei mesi a due anni e della multa nel limite massimo di euro 3000.
1. 224. Daniele Farina, Migliore, Sannicandro, Nicchi, Aiello, Piazzoni, Paglia, Zaccagnini.
Al comma 24-ter, lettera a), capoverso, aggiungere, in fine, le parole: Se le attività illecite hanno ad oggetto le sostanze di cui all'articolo 14, comma 1, lettera b) (Tabella II), si applica la pena della reclusione da tre mesi ad un anno e una multa nel limite di euro 5000.
1. 214. Zaccagnini.
Al comma 24-ter, lettera b), capoverso, quarto periodo, dopo la parola: irrogata aggiungere le seguenti: e comunque per un tempo non inferiore a nove mesi.
1. 205. Molteni.
Al comma 24-ter, lettera b), capoverso, quarto periodo, dopo la parola: irrogata aggiungere le seguenti: e comunque per un tempo non inferiore a otto mesi.
1. 221. Rondini.
Al comma 24-ter, lettera b), capoverso, quarto periodo, dopo la parola: irrogata aggiungere le seguenti: e comunque per un tempo non inferiore a sette mesi.
1. 231. Rondini.
Al comma 24-ter, lettera b), capoverso, quarto periodo, dopo la parola: irrogata aggiungere le seguenti: e comunque per un tempo non inferiore a sei mesi.
1. 206. Molteni.
Al comma 24-ter, lettera b), capoverso, sopprimere l'ultimo periodo.
*1. 215. Ferraresi, Turco, Paolo Bernini, Agostinelli, Bonafede, Businarolo, Colletti, Sarti.
Al comma 24-ter, lettera b), capoverso, sopprimere l'ultimo periodo.
*1. 222. Daniele Farina, Migliore, Sannicandro, Nicchi, Aiello, Piazzoni, Paglia, Zaccagnini.
Al comma 24-quater, lettera a), sostituire il capoverso con il seguente: «Chiunque, per farne uso personale, illecitamente importa, esporta, acquista, coltiva, riceve a qualsiasi titolo o comunque detiene sostanze stupefacenti o psicotrope di cui alle tabelle I e III previste dall'articolo 14, è sottoposto, per un periodo non inferiore a due mesi e non superiore a un anno, a una o più delle seguenti sanzioni amministrative».
1. 234. Turco, Ferraresi, Paolo Bernini, Agostinelli, Bonafede, Businarolo, Colletti, Sarti.
Al comma 24-quater, lettera a), dopo la parola: acquista aggiungere la seguente: coltiva;
Conseguentemente, al medesimo capoverso, sostituire le parole: nelle tabelle II e IV previste con le seguenti: nella tabella IV prevista.
1. 235. Daniele Farina, Migliore, Sannicandro, Nicchi, Aiello, Piazzoni, Paglia, Zaccagnini.
Al comma 24-quater, lettera a), sostituire le parole: da due mesi a un anno con le seguenti: comunque non inferiore a quattro mesi e non superiore a un anno.
1. 237. Rondini.
Al comma 24-quater, lettera a), sostituire le parole: da due mesi a un anno con le seguenti: comunque non inferiore a tre mesi e non superiore a un anno.
1. 236. Rondini.
Al comma 24-quater, lettera a), sostituire le parole: da uno a tre mesi con le seguenti: da tre a sei mesi.
1. 239. Rondini.
Al comma 24-quater, lettera a), sostituire le parole: da uno a tre mesi con le seguenti: da due a sei mesi.
1. 238. Rondini.
Al comma 24-quater, sopprimere la lettera b).
1. 220. Giorgia Meloni, Rampelli.
Al comma 24-quater, lettera b), alinea, sostituire le parole: è inserito il seguente con le seguenti: sono inseriti i seguenti.
Conseguentemente, alla medesima lettera, dopo il capoverso 1-bis, aggiungere il seguente:
«1-ter. Le sanzioni previste alla lettera a), c) e d) del comma 1 non si applicano alle sostanze di cui alla Tabella II dell'articolo 14».
1. 512. Daniele Farina, Migliore, Sannicandro, Nicchi, Aiello, Piazzoni, Paglia.
Al comma 28, lettera d), capoverso comma 4, aggiungere, in fine, il seguente periodo: In tal caso è fatta salva l'opzione da parte del servizio pubblico di sostenere gli oneri del trattamento a seguito di valutazione, da parte dello stesso, della congruità e appropriatezza del trattamento presso la struttura privata scelta ai sensi del presente comma.
1. 42. Di Vita, Cecconi, Baroni, Dall'Osso, Silvia Giordano, Grillo, Lorefice, Mantero.
Al comma 29, capoverso comma 8, aggiungere, in fine, le parole: che devono essere utilizzati, in base alle buone pratiche cliniche ed alle evidenze scientifiche, con finalità terapeutiche e riabilitative in integrazione con i più appropriati interventi psico-sociali.
1. 43. Silvia Giordano, Cecconi, Baroni, Dall'Osso, Di Vita, Grillo, Lorefice, Mantero.
Dopo il comma 30, aggiungere il seguente:
30-bis. Entro il 31 dicembre 2015 tutti i registri di cui agli articoli 60, 61, 62, 63, 64, 65, 66 e 67 del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, devono prevedere una registrazione esclusivamente su supporto informatico della movimentazione delle sostanze e dei medicinali di cui alle tabelle del presente decreto legge. Il Ministero della salute adotta le modalità di registrazione nonché di invio dei dati in essi contenuti e della relativa tracciabilità di tutti gli atti relativi a transazioni, trasporti, vendite o cessioni di sostanze stupefacenti, stabilite dal decreto del Ministro della salute 11 maggio 2010.
1. 101. Grillo, Cecconi, Baroni, Dall'Osso, Di Vita, Silvia Giordano, Lorefice, Mantero.
Dopo l'articolo 1, aggiungere il seguente:
«Art.1-bis. 1. Le pene irrogate con sentenza divenuta definitiva prima della data di pubblicazione della sentenza della Corte Costituzionale n. 32 del 12 febbraio 2014, per i reati di cui all'articolo 73, comma 1, del decreto del Presidente della Repubblica n. 309 del 1990, riferiti alle sostanze di cui alla tabella II dell'articolo 14, commessi dopo l'entrata in vigore della legge 21 febbraio 2006, n. 49, sono ridotte di due terzi.
2. Se per effetto della riduzione le pene risultano superiori al massimo edittale, queste sono ridotte al limite massimo ivi previsto.
3. Alla rideterminazione della pena provvede con decreto, anche d'ufficio, il giudice dell'esecuzione.
4. Il giudice può concedere la sospensione condizionale della pena e la non menzione della condanna nel certificato del casellario giudiziale, quando ciò consegue alla rideterminazione della pena.
5. La Corte di cassazione, se non deve annullare per altri motivi la sentenza di condanna per i reati di cui al comma 1 commessi prima della data di pubblicazione della sentenza della Corte costituzionale n. 32 del 12 febbraio 2014, riduce di due terzi la pena irrogata dal giudice di merito».
1. 0500. Daniele Farina, Migliore, Sannicandro, Nicchi, Aiello, Piazzoni, Paglia, Zaccagnini.
Dopo l'articolo 1, aggiungere il seguente:
Art. 1-bis. (Modifiche al codice di procedura penale). – 1. All'articolo 380, comma 2, la lettera h), è sostituita dalla seguente: h) «delitti concernenti sostanze stupefacenti o psicotrope puniti a norma dell'articolo 73 del testo unico approvato con decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, limitatamente ai fatti inerenti alle sostanze indicate nelle tabelle I e III di cui all'articolo 14 del medesimo decreto, salvo che ricorra la circostanza prevista dal comma 5 del medesimo decreto».
2. All'articolo 381 comma 2 del codice di procedura penale è aggiunta la seguente lettera: «d-bis) delitti concernenti sostanze stupefacenti o psicotrope puniti a norma dell'articolo 73 del testo unico approvato con decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, limitatamente ai fatti inerenti alle sostanze indicate nelle tabelle II e IV di cui all'articolo 14 del medesimo decreto, salvo che ricorra la circostanza prevista dal comma 5 del medesimo decreto».
1. 050. Ferraresi, Turco, Paolo Bernini, Agostinelli, Bonafede, Businarolo, Colletti, Sarti.
ART. 2.
(Efficacia degli atti amministrativi adottati ai sensi del decreto del Presidente della Repubblica 9 ottobre 1990, n. 309).
Sostituirlo con il seguente:
Art. 2. – (Efficacia degli atti amministrativi adottati ai sensi del decreto del Presidente della Repubblica 9 ottobre 1990, n. 309). – 1. Fermo restando quanto previsto dall'articolo 30 della legge 11 marzo 1953, n. 87, a decorrere dalla data di entrata in vigore del presente decreto, in ordine agli atti adottati sino alla data di pubblicazione della sentenza della Corte Costituzionale n. 32 del 12 febbraio 2014, ai sensi del testo unico delle leggi in materia di disciplina degli stupefacenti e sostanze psicotrope, prevenzione, cura e riabilitazione dei relativi stati di tossicodipendenza, di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, e successive modificazioni:
a) se si tratta di atti amministrativi, continuano a produrre effetti;
b) se si tratta di sentenze penali di condanna, il giudice dell'esecuzione provvede, anche d'ufficio, alla revoca, limitatamente alla pena inflitta relativamente alle condotte concernenti le sostanze indicate all'articolo 4-vicies ter, comma 3, numero 6, del decreto-legge 30 dicembre 2005, n. 272, convertito, con modificazioni dalla legge 21 febbraio 2006, n. 49, oggetto della predetta declaratoria. Alla revoca provvede, nelle forme previste dall'articolo 673 del codice di procedura penale, il giudice dell'esecuzione, che ridetermina la pena, applicando la dosimetria adottata con la sentenza di condanna.
2. Il giudice può concedere la sospensione condizionale della pena e la non menzione della condanna nel certificato del casellario giudiziale, quando ciò consegue alla rideterminazione della pena. Il giudice dell'esecuzione ridetermina altresì, con le medesime modalità, la pena irrogata ai sensi dell'articolo 73, comma 5, del predetto testo unico di cui al decreto del Presidente della Repubblica 9 ottobre 1990, n. 309, come modificato dall'articolo 2, comma 1, lettera a), del decreto-legge 23 dicembre 2013, n. 146, convertito, con modificazioni, dalla legge 21 febbraio 2014, n. 10.
2. 500. Zaccagnini.
Aggiungere, in fine, il seguente comma:
1-ter. Entro sessanta giorni dalla data di entrata in vigore della legge di conversione del presente decreto, gli atti amministrativi di cui al comma 1 del presente articolo devono essere riformulati o soppressi tenuto conto delle disposizioni previste dal presente decreto.
2. 100. Lorefice, Cecconi, Baroni, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Mantero.
ART. 3.
(Disposizioni in materia di impiego di medicinali).
Sostituire il comma 2 con i seguenti:
2. Dopo il comma 4 dell'articolo 1 del decreto-legge 21 ottobre 1996, n. 536, convertito dalla legge 23 dicembre 1996, n. 648, sono aggiunti i seguenti:
«4-bis. Nel caso in cui l'autorizzazione all'immissione in commercio di un medicinale non comprenda un'indicazione terapeutica per la quale si ravvisi un motivato interesse pubblico all'utilizzo, valutato, sulla base di sperimentazioni nazionali e/o internazionali o estensioni di autorizzazioni da parte di Stati appartenenti all'Unione europea, che il medicinale possieda un profilo di sicurezza, con riferimento all'impiego proposto, non inferiore a quella del farmaco autorizzato, l'Agenzia Italiana del Farmaco procede ad acquisire tali studi scientifici o estensioni di autorizzazioni e dà avvio all’iter per l'estensione di autorizzazione.
4-ter. Anche se sussista altra alternativa terapeutica nell'ambito dei farmaci autorizzati, l'indicazione terapeutica per la quale sia stato avviato l’iter di registrazione ai sensi del comma 4-bis è inserita provvisoriamente nell'elenco di cui al comma 4 con conseguente erogazione dello stesso a carico del Servizio sanitario nazionale, nel caso in cui, a giudizio della Commissione tecnico-scientifica dell'AIFA, tenuto conto dei risultati delle eventuali sperimentazioni e ricerche condotte nell'ambito della comunità medico-scientifica nazionale e internazionale, nonché della relativa onerosità del farmaco autorizzato per il Servizio sanitario nazionale, il farmaco sia sicuro ed efficace con riferimento all'impiego proposto rispetto a quello autorizzato. In tal caso, il Ministero della salute per il tramite dell'AIFA attiva idonei strumenti di monitoraggio a tutela della sicurezza dei pazienti ed assume tempestivamente le necessarie determinazioni.
4-quater. L'inserimento provvisorio ai sensi del comma 4-ter è disposto in attesa che siano disponibili i risultati delle sperimentazioni cliniche in strutture pubbliche condotte sul farmaco e diviene definitivo previa valutazione positiva della Commissione tecnico-scientifica dell'AIFA ai sensi dell'articolo 2, comma 349, della legge 24 dicembre 2007, n. 244.
4-quinquies. Quando la valutazione di equivalenza di sicurezza ed efficacia di cui al comma 4-bis, sia stata già effettuata dal corrispondente organismo dell'EMA o dell'OMS, ovvero quando questi raccomandino l'uso del farmaco per un uso non autorizzato, AIFA procede ad acquisire da dette autorità la predetta valutazione raccomandazione, nonché gli studi sulla base dei quali essa valutazione raccomandazione è fondata, ed estende senza indugio l'autorizzazione all'uso non autorizzato. I titolari di AIC o altri aventi causa dei farmaci autorizzati per la stessa indicazione terapeutica possono chiedere che sia effettuata a loro spese sperimentazione multicentrica allo scopo di verificare equivalenza di sicurezza ed efficacia, almeno, presso strutture sanitarie pubbliche, indicate in sede di Conferenza Stato-Regioni.
4-sexies. Previa autorizzazione dell'AIFA, rilasciata su proposta della regione competente, la farmacia ospedaliera può, attraverso operazioni di ripartizione del quantitativo di un medicinale regolarmente in commercio, allestire dosaggi da utilizzare all'interno dell'ospedale in cui opera o all'interno di altri ospedali, ovvero da consegnare all'assistito per impiego domiciliare sotto il controllo della struttura pubblica. Il disposto del presente comma si applica anche nell'ipotesi di utilizzazione di un medicinale per un'indicazione diversa da quella autorizzata, ai sensi del comma 4.
4-septies. Se il titolare dell'AIC o altro avente causa si oppone all'estensione di autorizzazione di cui ai commi 4-bis o 4-quinquies o a quanto previsto nel comma 4-sexies, le responsabilità di cui all'articolo 114 del decreto legislativo 6 settembre 2005, n. 206 e seguenti sono a totale carico dello Stato italiano.».
2-bis. È abrogata ogni norma in contrasto con il presente decreto.
3. 108. Baroni, Cecconi, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Lorefice, Mantero.
Sostituire il comma 2 con il seguente:
2. Dopo il comma 4 dell'articolo 1 del decreto-legge 21 ottobre 1996, n. 536, convertito dalla legge 23 dicembre 1996, n. 648, sono aggiunti i seguenti:
«4-bis. Nel caso in cui l'autorizzazione all'immissione in commercio di un medicinale non comprenda un'indicazione terapeutica per la quale si ravvisi un motivato interesse pubblico all'utilizzo, qualora il titolare dell'AIC o altro avente causa dichiari di non voler procedere direttamente alla registrazione dell'indicazione di interesse, entro trenta giorni dalla comunicazione di motivato interesse pubblico ed anche se sussista altra alternativa terapeutica nell'ambito dei farmaci autorizzati per la medesima indicazione, acquisito il parere della Commissione tecnico-scientifica dell'AIFA, sulla base dei risultati delle sperimentazioni e ricerche condotte nell'ambito della comunità medico-scientifica nazionale o internazionale in merito alla sicurezza ed efficacia del farmaco con riferimento all'impiego proposto rispetto a quello autorizzato, valutato altresì il vantaggio economico per il Servizio sanitario nazionale, il Ministero della salute inserisce provvisoriamente nell'elenco di cui al comma 4 con conseguente erogazione dello stesso a carico del Servizio sanitario nazionale. In tal caso il Ministero della salute tramite AIFA assume tempestivamente le necessarie determinazioni ed attiva contestualmente alla registrazione idonei strumenti di monitoraggio a tutela della sicurezza dei pazienti, in coordinamento con le strutture pubbliche del Servizio sanitario nazionale.
4-ter. I farmaci oggetto di tale registrazione entrano a pieno titolo nelle acquisizioni per il Sistema sanitario nazionale, inserendoli nelle gare, fino a motivata revoca di AIFA dell'inserimento in elenco.
4-quater. Nell'esercizio della rilevante responsabilità pubblica di cui al presente articolo, l'AIFA si avvale delle più avanzate esperienze in ambito regionale, fornendo completa informazione di tali collaborazioni e dei loro contenuti con pubblicazione sul proprio sito, in tempo reale.
4-quinquies. È abrogato il comma 796, lettera z), della legge 27 dicembre 2006, n. 296.»
3. 109. Cecconi, Baroni, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Lorefice, Mantero.
Sostituire il comma 2 con il seguente:
2. Al comma 4 dell'articolo 1 del decreto-legge 21 ottobre 1996, n. 536, convertito, con modificazioni, dalla legge 23 dicembre 1996, n. 648, dopo il primo periodo, sono aggiunti i seguenti: «Se è disponibile un'alternativa terapeutica nell'ambito dei farmaci autorizzati, la presenza nell'elenco di cui al precedente periodo del medicinale non autorizzato, con conseguente erogazione dello stesso a carico del Servizio sanitario nazionale, è ammessa nel caso in cui sulla base del parere della Commissione tecnico-scientifica dell'AIFA o, in alternativa tra loro, l'equivalente organismo dell'EMA o dell'OMS, il medicinale possieda un profilo di sicurezza, con riferimento all'impiego proposto, non inferiore a quella del farmaco autorizzato e quest'ultimo risulti eccessivamente oneroso per il Servizio sanitario nazionale. Agli effetti del presente comma il medicinale già autorizzato è considerato eccessivamente oneroso se il costo medio della terapia basata sul suo impiego supera di almeno il 50 per cento il costo medio della terapia basata sull'impiego del farmaco non autorizzato. Previa autorizzazione dell'AIFA, rilasciata su proposta della regione competente, la farmacia ospedaliera può, attraverso operazioni di ripartizione del quantitativo di un medicinale regolarmente in commercio, allestire dosaggi da utilizzare all'interno dell'ospedale in cui opera o all'interno di altri ospedali, ovvero da consegnare all'assistito per impiego domiciliare sotto il controllo della struttura pubblica. Il disposto del presente comma si applica anche nell'ipotesi di utilizzazione di un medicinale per un'indicazione diversa da quella autorizzata, ai sensi del presente comma.»
3. 19. Mantero, Cecconi, Baroni, Dall'Osso, Di Vita, Silvia Giordano, Grillo, Lorefice.
Al comma 2, capoverso comma 4-bis, primo periodo, sopprimere le parole: previa valutazione dell'Agenzia Italiana del Farmaco (AIFA).
Conseguentemente, al medesimo capoverso, medesimo periodo: dopo le parole: da quella autorizzata aggiungere le seguenti: previo rilascio da parte dell'Agenzia Italiana del Farmaco di espressa dichiarazione di pubblico interesse;
sostituire la parola: purché con la seguente: qualora.
3. 105. Catalano, Zaccagnini.
Al comma 2, capoverso comma 4-bis, primo periodo, sostituire le parole: tale indicazione sia nota e conforme a con le seguenti: ciò avvenga sulla base di comprovate evidenze di efficacia e sicurezza documentate da.
*3. 100. Pagano, Roccella, Calabrò.
Al comma 2, capoverso comma 4-bis, primo periodo, sostituire le parole: tale indicazione sia nota e conforme a con le seguenti: ciò avvenga sulla base di comprovate evidenze di efficacia e sicurezza documentate da.
*3. 101. Gigli, Binetti.
Al comma 2, capoverso comma 4-bis, primo periodo, sostituire le parole:, secondo parametri di economicità ed appropriatezza con le seguenti: ovvero a sperimentazioni condotte in conformità alle linee guida dell'Unione europea di buona pratica clinica vigenti, nonché secondo il parametro dell'economicità per il Servizio sanitario nazionale.
3. 104. Catalano, Zaccagnini.
Al comma 2, capoverso comma 4-bis, dopo il primo periodo, aggiungere il seguente: Agli effetti del presente comma il medicinale già autorizzato è considerato eccessivamente oneroso se il costo medio della terapia basata sul suo impiego supera di almeno il 50 per cento il costo medio della terapia basata sull'impiego del farmaco non autorizzato.
3. 107. Di Vita, Cecconi, Baroni, Dall'Osso, Silvia Giordano, Grillo, Lorefice, Mantero.
Al comma 2, capoverso comma 4-bis, secondo periodo, sostituire le parole: l'AIFA con le seguenti: il Ministero della salute per il tramite dell'AIFA.
3. 106. Silvia Giordano, Cecconi, Baroni, Dall'Osso, Di Vita, Grillo, Lorefice, Mantero.
Al comma 2, dopo il capoverso comma 4-bis, aggiungere il seguente: 4-ter. Le deliberazioni adottate dall'Agenzia Italiana del Farmaco ai sensi del comma 4-bis, idonee a consentire l'erogazione del medicinale a carico del Servizio sanitario nazionale sono trasmesse alla Corte dei conti per la relativa registrazione.
3. 102. Catalano, Zaccagnini.
Al comma 2, dopo il capoverso comma 4-bis, aggiungere il seguente:
«4-ter. Il procedimento di cui al comma 4-bis, può essere iniziato d'ufficio dall'Agenzia Italiana del Farmaco o ad istanza di associazioni di malati, società scientifiche, aziende sanitarie, università, istituti di ricovero e cura a carattere scientifico.»
3. 103. Catalano, Zaccagnini.
Dopo il comma 2, aggiungere il seguente:
2-bis. Il comma 2 dell'articolo 2 del decreto-legge 25 marzo 2013, n. 24, convertito, con modificazioni, dalla legge 23 maggio 2013, n. 57, è sostituito dal seguente:
«2. I medici che hanno in cura i pazienti che hanno iniziato trattamenti con medicinali per terapie avanzate a base di cellule staminali mesenchimali, e non possono completare i trattamenti medesimi, debbono inviare all'Osservatorio di cui al comma 4-ter del presente articolo sotto la loro stretta responsabilità una relazione mensile sullo stato del paziente, a cui sono garantiti:
a) una adeguata informazione scientifica sugli avanzamenti scientifici e terapeutici che si rendano progressivamente disponibili;
b) terapie di mantenimento autorizzate, farmacologiche e non farmacologiche;
c) sostegno psicologico e counseling genetico alle famiglie. Agli oneri derivanti dall'applicazione delle disposizioni del presente comma si provvede nell'ambito delle risorse già accantonate per le sperimentazioni previste dal comma 2-bis del presente articolo.»
3. 115. Binetti, Gigli.
Dopo il comma 2, aggiungere il seguente:
2-bis. Il comma 2 dell'articolo 2 del decreto-legge 25 marzo 2013, n. 24, convertito, con modificazioni, dalla legge 23 maggio 2013, n. 57, è sostituito dal seguente:
«2. I medici che hanno in cura i pazienti che hanno iniziato trattamenti con medicinali per terapie avanzate a base di cellule staminali mesenchimali, e non possono completare i trattamenti medesimi, debbono inviare all'Osservatorio di cui al comma 4-ter del presente articolo sotto la loro stretta responsabilità una relazione mensile sullo stato del paziente, a cui sono garantiti:
a) una adeguata informazione scientifica sugli avanzamenti scientifici e terapeutici che si rendano progressivamente disponibili;
b) terapie di mantenimento autorizzate, farmacologiche e non farmacologiche;
c) sostegno psicologico e counseling genetico alle famiglie.
Dall'applicazione delle disposizioni del presente comma non derivano oneri aggiuntivi per il bilancio dello Stato.»
3. 116. Binetti, Gigli.
Dopo il comma 2, aggiungere il seguente:
2-bis. All'articolo 2, comma 2, del decreto-legge 25 marzo 2013, n. 24, convertito, con modificazioni, dalla legge 23 maggio 2013, n. 57, dopo le parole: «cellule e tessuti» sono aggiunte le seguenti: «e comunicate alle autorità competenti in materia di farmacovigilanza».
3. 110. Lenzi.
Dopo il comma 2, aggiungere il seguente:
2-bis. All'articolo 2, comma 2, del decreto-legge 25 marzo 2013, n. 24, convertito, con modificazioni, dalla legge 23 maggio 2013, n. 57, dopo le parole: «medico prescrittore» sono aggiunte le seguenti: «e di un medico della struttura dopo che sia stata conclusa la sperimentazione di cui al comma 2-bis e.».
3. 111. Lenzi.
Dopo il comma 2, aggiungere il seguente:
2-bis. All'articolo 2, comma 2-bis, del decreto-legge 25 marzo 2013, n. 24, convertito, con modificazioni, dalla legge 23 maggio 2013, n. 57, primo periodo, dopo la parola: «promuove» sono aggiunte le seguenti: «, dopo averne verificato la fattibilità,».
3. 112. Lenzi.
Dopo il comma 2, aggiungere il seguente:
2-bis. Ogni altro uso off-label di farmaci o terapie innovative che avvenga al di fuori delle procedure autorizzative previste nel presente decreto può essere effettuato solo su indicazione, responsabilità e stretto controllo del medico, il quale è tenuto a comunicare tempestivamente ad AIFA qualunque rilevante evento imprevisto o avverso dovesse determinarsi. Eventuali prescrizioni e autorizzazioni provenienti da qualunque altra fonte non hanno alcun valore cogente per le strutture del Servizio sanitario nazionale.
3. 114. Gigli, Binetti.
Dopo il comma 2, aggiungere il seguente:
2-bis. Ogni altro uso off-label di farmaci o terapie innovative che avvenga al di fuori delle procedure autorizzative previste nel presente decreto è effettuato solo su indicazione, responsabilità e stretto controllo del medico, il quale è tenuto a comunicare tempestivamente ad AIFA qualunque rilevante evento imprevisto o avverso dovesse determinarsi. Eventuali ordinanze autorizzative emesse da singoli magistrati sono da considerarsi nulle e non hanno alcun valore cogente per le strutture del Servizio sanitario nazionale.
3. 113. Binetti, Gigli.
Dopo l'articolo 3, aggiungere il seguente:
Art. 3-bis. – 1. All'articolo 15, del decreto-legge 6 luglio 2012, n. 95, convertito, con modificazioni, dalla legge 7 agosto 2012, n. 135, il comma 11-bis è sostituito dal seguente:
«11-bis. Il medico che curi un paziente, per la prima volta, per una patologia cronica, per il cui trattamento sono disponibili più medicinali equivalenti indica nella ricetta del Servizio sanitario nazionale la denominazione del principio attivo contenuto nel farmaco. Le norme in contrasto con quanto previsto dal presente comma sono soppresse.
2. Ai fini del contenimento della spesa farmaceutica, le Regioni e le province autonome di Trento e Bolzano, entro un anno dalla data di entrata in vigore della presente legge, devono realizzare infrastrutture tecnologiche per le prescrizioni mediche digitali condivise a livello interregionale, ovvero avvalersi, anche mediante riuso, ai sensi del decreto legislativo 7 marzo 2005, n. 82, delle infrastrutture tecnologiche per le prescrizioni mediche digitali, a tal fine già realizzate da altre regioni o dei servizi da queste erogati. Tali piattaforme dovranno assicurare piena interoperabilità tra sistemi di telecomunicazioni.
3. Al fine della razionalizzazione, distribuzione e contenimento della spesa farmaceutica, il Ministro della salute di concerto con il Ministro dell'economia e delle finanze, sentita la Conferenza Stato-Regioni e l'AIFA, previo parere delle competenti Commissioni parlamentari, entro un anno dalla data di entrata in vigore della presente legge, sono delegati ad emanare, un decreto per determinare le modalità per la produzione e distribuzione dei farmaci anche in forma di monodose.
4. L'applicazione del presente articolo non deve comportare maggiori oneri per la finanza pubblica.».
3. 02. Dall'Osso, Grillo, Cecconi, Baroni, Di Vita, Silvia Giordano, Lorefice, Mantero.









