DELLE GIUNTE E DELLE COMMISSIONI PARLAMENTARI
ALLEGATO 1
5-06752 Bernardini: Iniziative per assicurare le tempestività degli interventi chirurgici per il cambio di sesso.
TESTO DELLA RISPOSTA
In merito a quanto riportato nella interrogazione parlamentare in esame, la Prefettura – Ufficio Territoriale del Governo di Trieste ha comunicato che, presso la Struttura Complessa Clinica Urologica dell'Azienda Ospedaliere-Universitaria Ospedali Riuniti di Trieste, esistono professionalità e risorse per poter affrontare interventi chirurgici di conversione andro-ginoide e gino-androide per disturbi di identità di genere (DIG).
Il percorso clinico-autorizzativo per l'effettuazione di tali interventi prevede il nulla osta della Magistratura per poter effettuare un intervento demolitivo-ricostruttivo di tale portata.
Nell'ambito della programmazione operatoria aziendale (assegnazione di sala operatoria alle singole strutture chirurgiche), viene garantita una dotazione di risorse che permette di garantire i tempi di attesa regionali, con particolare attenzione alle classi di priorità A e B (interventi chirurgici prioritari con tempi di attesa massimi rispettivamente di 30 e 60 giorni).
Alla Struttura Complessa Clinica Urologica sono state assegnate in media 5 sedute operatorie alla settimana nell'ultimo anno.
La composizione della lista operatoria è stilata in forma autonoma dai direttori delle strutture complesse chirurgiche nell'ambito delle proprie funzioni di organizzazione e funzionamento e, pertanto, non vi sono state ingerenze da parte della direzione sanitaria nella destinazione specifica delle risorse assegnate; la direzione sanitaria effettua inoltre un costante monitoraggio e promuove ed organizza frequenti incontri (di norma mensili), per analizzare i tempi di attesa e le risorse necessarie.
La Direzione Sanitaria aziendale ha precisato che non corrisponde al vero l'affermazione che non sia più possibile fare questi interventi, stante l'autonomia programmatoria della struttura e la numerosità dei casi operati (nel 2011 sono stati eseguiti n. 18 interventi).
Al fine di corrispondere alle richieste della equipe uro-andrologica, nel corso dell'anno 2011, è stato chiesto ai professionisti sanitari di presentare uno specifico progetto per incrementare l'offerta di sedute operatorie da destinare ai disturbi di identità di genere, il quale è attualmente alla valutazione delle O.O.S.S.
Per quanto riguarda i dati relativi agli interventi di cambiamento di sesso eseguiti in Italia negli ultimi cinque anni, questo Ministero ha preso in esame l'archivio delle schede di dimissioni ospedaliere, con riferimento all'attività ospedaliera degli ultimi cinque anni (2007-2011).
In particolare, sono state prese in esame tutte le dimissioni in ricovero ordinario, caratterizzate da una diagnosi principale di «transessualismo» o di «disturbo dell'identità di genere nell'adolescente o nell'adulto», in associazione ad almeno una delle seguenti procedure chirurgiche:
orchiectomia bilaterale nello stesso intervento;
amputazione del pene;
interventi per trasformazione di sesso non classificati altrove;Pag. 148
costruzione della vagina;
impianto di protesi bilaterale;
altra laringectomia parziale;
riparazione di frattura della laringe;
elettrolisi e altra depilazione cutanea;
isterectomia addominale totale;
altra rimozione di entrambe le ovaie e delle tube nello stesso intervento;
inserzione di espansore tessutale;
incisione con rimozione di corpo estraneo da cute e tessuto sottocutaneo.
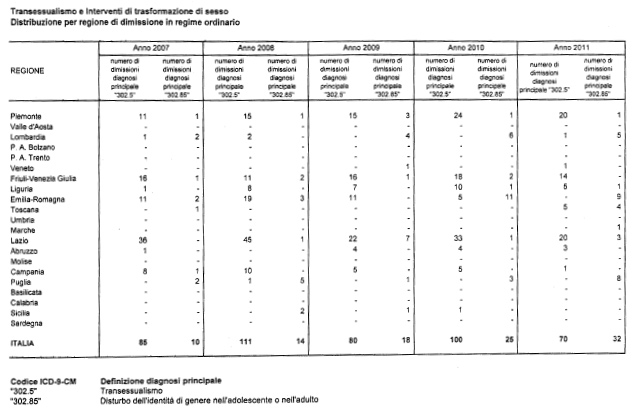
Lascio a disposizione degli onorevoli interroganti e della Commissione una tabella che riporta – per le diagnosi di transessualismo e disturbo dell'identità di genere – la distribuzione delle dimissioni ospedaliere per ciascuna Regione dal 2007 al 2011.
A livello nazionale, i valori massimi di tale distribuzione si rilevano negli anni 2008 e 2010, con 125 dimissioni.
Dal 2007 è in aumento il numero di dimissioni con diagnosi «disturbo dell'identità di genere», che passano da 10 a 32 nell'anno 2011.
Nel quinquennio, le Regioni in cui si è registrato il maggior numero di ricoveri sono, in ordine decrescente, Lazio, Piemonte, Friuli Venezia Giulia, Emilia Romagna.
Nell'ultimo anno preso in esame, si osserva una complessiva diminuzione delle dimissioni in tutte le Regioni, con le sole eccezioni di Toscana e Puglia.
In Toscana si rilevano 10 casi nel quinquennio, di cui 9 nel 2011; in Puglia si è passati da una media annuale di 3 dimissioni ospedaliere negli anni 2007-2010 ad 8 dimissioni nel 2011.
ALLEGATO 2
5-06761 Bernardini: Ispezione presso la casa famiglia «Dina Sergiacomi» sita a Montalto delle Marche.
5-06762 Bernardini: Verifica sulla regolarità di un trattamento sanitario obbligatorio su una donna già ospite della casa famiglia «Dina Sergiacomi».
TESTO DELLA RISPOSTA
In merito alla vicenda riportata nelle interrogazioni parlamentari in esame, si risponde fornendo le informazioni acquisite dalla Prefettura – Ufficio territoriale del Governo di Ascoli Piceno.
In data 30 marzo 2012, il Sindaco di Montalto delle Marche (Ascoli Piceno), chiedeva al Comando Carabinieri – Stazione di Montalto delle Marche di intervenire presso la strada provinciale cuprense, dove si stava eseguendo un Trattamento Sanitario Obbligatorio (T.S.O.) nei confronti di una donna di San Benedetto del Tronto, ospite della comunità per gestanti e madri con figli a carico «Dina Sergiacomi» di Montalto delle Marche.
Il personale dell'Arma intervenuto sul posto accertava la presenza di addetti al Servizio 118 dell'ospedale di Ascoli Piceno con due ambulanze, del Sindaco di Montalto e di alcune persone della citata Comunità.
Si accertava, inoltre, che la richiesta di intervento ai Carabinieri era stata determinata dall'impossibilità di reperire personale del locale comando di Polizia Municipale e che la procedura per il T.S.O. era stata richiesta in quanto, nella stessa serata, la giovane donna era stata sorpresa dal Sindaco mentre girovagava per le vie di Montalto delle Marche in evidente stato di ubriachezza.
Il primo cittadino, in qualità di medico, dopo aver tentato senza successo – più volte – di convincere la donna a ricorrere alle cure mediche, aveva deciso di avviare la procedura per il T.S.O.
Nella circostanza il medico sopraggiunto con il Servizio 118, benché avesse constatato l'evidente stato di alterazione della donna, e dopo aver tentato a sua volta di convincerla a sottoporsi alle cure mediche, non riteneva in un primo momento necessario il T.S.O.
Successivamente, il sanitario del Servizio 118 decideva invece di convalidare il trattamento obbligatorio, dopo aver avuto un colloquio con il direttore della cooperativa «San Marco» (che gestisce la Comunità Sergiacomi), il quale aveva reso noto che non sarebbe stato consentito il rientro in comunità della donna, al fine di tutelare i due figli minori.
Questa decisione induceva la paziente a manifestare propositi suicidi.
Il personale dell'Arma, quindi, procedeva a coadiuvare i sanitari e a scortare l'ambulanza sino all'ospedale di Ascoli Piceno: durante il tragitto, la donna ha mantenuto un comportamento calmo e tranquillo.
In merito a quanto accaduto, la Procura della Repubblica presso il Tribunale di Ascoli Piceno, a seguito di esposto sui fatti, delegava il Comando Stazione Carabinieri di Montalto delle Marche ad effettuare accertamenti volti a verificare il corretto operato dei medici.
Le indagini sono tuttora in corso.
Il 23 marzo 2012, Carabinieri appartenenti al Nucleo Antisofisticazioni e Sanità (N.A.S.) di Ancona ed alla stessa Stazione Pag. 151di Montalto delle Marche, unitamente ad alcuni addetti della Polizia giudiziaria, nonché a personale appartenente alla Azienda Sanitaria Unica Regionale n. 5 di Ascoli Piceno, effettuavano accertamenti presso la comunità «Dina Sergiacomi».
Il 2 aprile 2012, un piccolo gruppo di persone, nei pressi della citata comunità, manifestava dissenso nei confronti del provvedimento adottato.
Il 5 aprile 2012, il Tribunale per i minorenni di Ancona ha revocato l'autorizzazione concessa alla donna di poter seguire i propri figli, che venivano, quindi, trasferiti presso altra struttura.
Alla luce degli elementi informativi sopra resi, per gli aspetti di limitata competenza, questo Ministero non ritiene di dover avviare specifiche iniziative in ordine alla questione in esame.
ALLEGATO 3
5-06042 Farina Coscioni: Mancata adozione delle linee guida per l'accreditamento degli istituti dei tessuti e dei centri di procreazione medicalmente assistita (PMA) ai sensi del decreto legislativo n. 191 del 2007.
TESTO DELLA RISPOSTA
Con riferimento alla interrogazione in esame, si osserva quanto segue.
Per quanto riguarda il settore della procreazione medicalmente assistita (PMA), le linee guida per l'autorizzazione e l'accreditamento dei centri e i relativi requisiti minimi organizzativi, strutturali e tecnologici, cui fa riferimento l'articolo 6 del decreto legislativo n. 191 del 2007, esistevano già e sono da ricondurre a quelle emanate a seguito della legge n. 40 del 2004, approvate dalla Conferenza dei Presidenti delle Regioni e Province Autonome in data 11 novembre 2004 e formalizzate da ogni singola Regione con proprio atto, a volte con specifiche ulteriori integrazioni.
Si tratta del livello iniziale utilizzato dalle Regioni e Province autonome per autorizzare all'esercizio (ed eventualmente accreditare) i Centri PMA, precedentemente alla emanazione della normativa di matrice europea su cellule e tessuti.
Il documento redatto dall'Osservatorio sull'applicazione del decreto legislativo n. 191 del 2007 alla procreazione medicalmente assistita, istituito con decreto ministeriale 23 giugno 2009 e composto da rappresentanti del Ministero della salute, delle Regioni, del Centro Nazionale Trapianti (CNT), dell'Istituto Superiore di Sanità e da esperti del settore PMA, riguarda invece, in particolare, i requisiti ulteriori di qualità e sicurezza discendenti dalle Direttive Europee su cellule e tessuti e dai relativi decreti legislativi di recepimento (decreto legislativo 6 novembre 2007, n. 191, che recepisce la direttiva 2004/23/CE e il decreto legislativo 25 gennaio 2010, n. 16, che recepisce le due direttive attuative 2006/17/CE e 2006/86/CE, contenenti le prescrizioni tecniche per la donazione, l'approvvigionamento, il controllo, la lavorazione, la conservazione, lo stoccaggio e la distribuzione di cellule umane, nonché per quanto riguarda le prescrizioni in tema di rintracciabilità, la notifica di reazioni ed eventi avversi gravi e determinate prescrizioni tecniche per la codifica, la lavorazione, la conservazione, lo stoccaggio e la distribuzione di tessuti e cellule umani).
Tale documento ha fornito la base per l'Accordo Stato Regioni sul documento concernente «Requisiti minimi organizzativi, strutturali e tecnologici delle strutture sanitarie autorizzate di cui alla legge 19 febbraio 2004, n. 40 (Centri di Procreazione Medicalmente Assistita), per la qualità e la sicurezza nella donazione, l'approvvigionamento, il controllo, la lavorazione, la conservazione, lo stoccaggio e la distribuzione di cellule umane, sancito il 15 marzo 2012 dalla Conferenza permanente per i rapporti tra lo Stato, le Regioni e le Province autonome di Trento e Bolzano.
Con l'Accordo del 15 marzo 2012, in sostanza, oltre a definire i requisiti minimi dei Centri di PMA in attuazione delle prescrizioni stabilite dal decreto legislativo 6 novembre 2007, n. 191 e dal decreto legislativo 25 gennaio 2010, n. 16, si è anche convenuto che:
«i contenuti del presente Accordo costituiscono anche linee guida per l'accreditamento, Pag. 153ai sensi dell'articolo 6, comma 1, del decreto legislativo n. 191 del 2007»;
«i requisiti di cui all'allegato comprendono quelli già definiti dalle Regioni e dalle Province autonome con proprio atto, ai sensi dell'articolo 10, comma 2 della legge 19 febbraio 2004, n. 40».
Pertanto, pur non esistendo un'incertezza su quali siano i requisiti tecnici di qualità e sicurezza a cui i Centri PMA devono attenersi, dal momento che i decreti legislativi n. 191 del 2007 e n. 16 del 2010 derivano da Direttive Europee e sono vincolanti per tutti gli istituti dei tessuti, con l'Accordo Stato Regioni del 15 marzo 2012 sono stati integrati i requisiti per l'autorizzazione e l'accreditamento già previsti con le ulteriori prescrizioni derivate dalle normative di recepimento di direttive europee (decreti legislativi n. 191 del 2007 e n. 16 del 2010).
Le Regioni quindi, ai sensi dell'articolo 6 del decreto legislativo n. 191 del 2007, sono responsabili del rilascio e dell'eventuale revoca delle autorizzazioni e dell'accreditamento dei Centri e delle loro relative attività.
Per quanto riguarda l'attività ispettiva, l'articolo 7 del decreto legislativo n. 191 del 2007 stabilisce che «la Regione organizza ispezioni e adeguate misure di controllo presso gli istituti dei tessuti, avvalendosi del supporto del Centro Nazionale Trapianti, per verificarne la rispondenza ai requisiti previsti dalla normativa vigente e dal presente decreto».
Detti controlli devono essere effettuati con cadenza biennale, ed hanno lo scopo di verificare la rispondenza dei Centri ai requisiti previsti dai decreti legislativi n. 191 del 2007 e n. 16 del 2010.
Pertanto, il CNT supporta le Regioni in questa specifica attività periodica di controllo ed ispezione dei Centri PMA, riguardo alla persistenza dei criteri di qualità e sicurezza previsti dai decreti legislativi n. 191 del 2007 e n. 16 del 2010.
L'articolo 4 del decreto legislativo n. 191 del 2007 individua nel Ministero della salute e nelle Regioni le Autorità responsabili competenti per l'attuazione dei requisiti, stabilendo compiti specifici.
Il Ministero della salute e le Regioni, ai sensi dell'articolo 1, comma 3, del decreto legislativo n. 16 del 2010 e dell'articolo 7 del decreto legislativo n. 191 del 2007, «si avvalgono della collaborazione del Centro Nazionale Trapianti» per l'attuazione delle disposizioni in materia di cellule riproduttive contenute negli stessi decreti legislativi.
In accordo con le Regioni, il CNT ha iniziato nel febbraio 2011 un percorso di verifica dei Centri PMA, per la conformità rispetto ai requisiti previsti.
Per quanto riguarda la trasmissione dei dati, non risulta che ci sia un sistema ridondante.
Infatti, i Centri inviano i dati riguardanti la loro attività al Registro istituito presso l'Istituto Superiore di Sanità; eventuali notifiche di evento/reazione avversa vengono comunicate al CNT, che prontamente e, comunque, entro le 48 ore, così come è noto a questa Commissione, ne dà notizia al Registro.
Per quanto riguarda la figura del responsabile dei Centri PMA, nell'Accordo Stato Regioni del 15 marzo 2012, nell'alleato, sezione B, punto 2, dal titolo «Responsabile», sono indicate le qualifiche minime che deve possedere il responsabile del Centro PMA, ed in particolare:
«possesso di un diploma di laurea in medicina rilasciato al termine di un corso di studi universitari e specializzazione in ginecologia; il responsabile del Centro PMA è affiancato (requisito indispensabile per i Centri di II e III livello) da un biologo, un biotecnologo o un medico con esperienza in medicina della riproduzione o con esperienza di laboratorio responsabile per tutti gli aspetti di specifica competenza laboratoristica, con almeno due anni di esperienza pratica Pag. 154nel settore della PMA; nel caso di una banca del seme il responsabile può essere anche un andrologo o endocrinologo o urologo con esperienze andrologiche e biologo con competenze di biologia della riproduzione».
Alla luce delle considerazioni sopra rese, si ritiene non necessario l'avvio di nuove iniziative normative, in considerazione, peraltro, che l'assetto normativo vigente è in linea con le disposizioni europee.
Pag. 155ALLEGATO 4
5-06046 Farina Coscioni: Disponibilità dei farmaci per i pazienti diabetici di tipo 2.
TESTO DELLA RISPOSTA
Come è noto, il diabete mellito di tipo 2 è la forma più comunemente diffusa, anche a causa della diffusione dell'obesità e dell'invecchiamento della popolazione, e rappresenta circa il 90 per cento dei casi di questa malattia. Fino a poco tempo fa, la terapia farmacologica del diabete, tipo 2 era basata in via quasi esclusiva sulla metformina, sui secretagoghi, sui glitazioni e sull'insulina.
Di recente, si è diffusa una nuova classe di farmaci, le cosiddette incretine, che comprendono gli agonisti del recettore del gastrointestinal like peptide (GPL-1), ARGLP-1, exenatide e liraglutide, e le glipitne (inibitori della dipeptil-peptidasi 4-DPP4). Con avviso del 27 dicembre 2011, l'AIFA ha pubblicato l'elenco aggiornato dei medicinali aventi il requisito dell'innovatività terapeutica, indicando questi prodotti come innovativi potenziali. Va detto, comunque, che, nonostante le comprovate e consolidate evidenze scientifiche, il Comitato Prezzi e Rimborsi dell'AIFA in una nota del 10 ottobre 2011, ha reso nota la spesa per i farmaci incretinici, paventando un unico tetto di spesa per i DDP-4 e i GPLI-1 pari a 57 milioni di euro, a fronte di 69 milioni di euro di consumo registrati negli ultimi 12 mesi, assoggettando indistintamente a tale limitazione due classi di farmaci con diverso codice anatomico, terapeutico e chimico e con diverse caratteristiche. Alla luce di tale misura, l'Associazione dei medici diabetologi e la Società italiana di diabetologia, con nota del 12 dicembre 2011, hanno inviato al Direttore generale dell'AIFA un position statement sulla terapia incretinica, evidenziando i benefìci connessi a tale approccio terapeutico.
Sembra il caso di osservare, inoltre, che i farmaci incretinici, arrivati in Italia nel 2008, promuovono la produzione di insulina da parte delle cellule del pancreas ed eliminano il rischio di ipoglicemia, l'effetto collaterale più temuto da coloro i quali soffrono di diabete.
Tali farmaci furono inseriti tra i farmaci innovativi, ai sensi e per gli effetti dell'articolo 5 della legge n. 222 del 2007, «Conversione in legge, con modificazioni, del decreto-legge 1o ottobre 2007, n. 159, recante interventi urgenti in materia economico-finanziaria, per lo sviluppo e l'equità sociale», pubblicata nella Gazzetta Ufficiale n. 279 del 30 novembre 2007 – Supplemento Ordinario n. 249/L.
Il possesso, da parte di un farmaco, del requisito dell'innovatività è riconosciuto dall'AIFA, sentito il parere formulato dalla Commissione consultiva tecnico-scientifica istituita presso la stessa Agenzia, e ha validità per 36 mesi, fatta salva la possibilità che essa possa rivalutare l'innovatività sulla base di nuovi ed ulteriori elementi tecnico-scientifici, resisi, intanto, disponibili.
I farmaci in parola sono stati inseriti nell'Accordo Stato-regioni del 18 novembre 2010 (articolo 1, comma 1), che ne statuisce il relativo inserimento nell'ambito del Prontuario Terapeutico Ospedaliero Regionale; pertanto, i farmaci incretinici continuano ad essere soggetti a rimborso dal S.S.N., senza alcuna limitazione prescrittiva, garantendo la piena disponibilità a tutti i pazienti diabetici che ne abbiano bisogno, al fine di una corretta gestione della terapia.Pag. 156
Del resto, le cosiddette sostanze incretine si inseriscono in un mercato contraddistinto da diverse peculiarità, nell'ambito del quale sono presenti, da lungo tempo, numerosi farmaci recanti indicazioni terapeutiche similari ed in parte sovrapponibili, ma aventi costi differenti.
Infatti, laddove le incretine presentano un costo ex factory di euro 1,51/die, altri farmaci della stessa area terapeutica, ovvero antidiabetici orali quali metformina, secretagoghi, glitazoni e insulina, mostrano un costo ex factory di gran lunga inferiore che si aggira tra euro 0,3-0,4/die fino ad un massimale di euro 0,9/die.
È evidente, pertanto, che i farmaci incretinici comportano un onere maggiore a carico del S.S.N., che deve essere valutato attentamente e scrupolosamente, tenendo in debito conto ciascuno dei benefici clinici reali apportati. Si consideri, infatti che nell'anno 2011 la spesa per detti farmaci ha superato una somma pari ai 57 milioni di euro.
Ad ogni buon conto, a partire dal mese di giugno 2011, le incretine sono oggetto di una nuova fase di negoziazione con le aziende farmaceutiche produttrici, ancora in corso, al fine di definirne il prezzo ed il tetto di spesa.
ALLEGATO 5
5-04052 Rondini: Stanziamenti di risorse finanziarie per la formazione specialistica dei farmacisti ospedalieri.
TESTO DELLA RISPOSTA
In merito alla problematica dei laureati in Farmacia, specializzandi in Farmacia ospedaliera, tuttora esclusi dalla disciplina cui è sottoposta la categoria degli specializzandi medici, con riguardo alla stipula del contratto di formazione specialistica, si precisa che in tale ambito sono coinvolte anche altre categorie di professionisti (fisici sanitari, psicologi, biologi, statistici, eccetera), tutte menzionate nell'articolo 8 della legge 29 dicembre 2000, n. 401.
Riguardo a tale norma, per renderne possibile l'attuazione, questo Ministero, già nel 2002, aveva attivato, unitamente al Ministero dell'istruzione, dell'università e della ricerca, una ricognizione delle scuole di specializzazione esistenti e interessate alla questione, al fine di quantificare l'onere economico che ne sarebbe derivato.
Occorre, infatti, precisare che detta norma, nel sancire per tali professionisti un diritto, non aveva, tuttavia, previsto alcuna copertura finanziaria, necessaria a far fronte agli ulteriori oneri.
Di conseguenza, l'oggettiva difficoltà di sottrarre risorse alla formazione dei medici, considerato che solo per quest'ultima categoria il diritto alla remunerazione durante il periodo di specializzazione discende da normative comunitarie, di fatto ne ha impedito la realizzazione.
Ulteriore elemento di criticità è derivato, inoltre, dall'attuazione degli articoli 37 e seguenti del decreto legislativo n. 368 del 1999, che prevedono l'applicazione ai medici specializzandi del contratto di formazione specialistica, in luogo della precedente borsa di studio, attesi i maggiori oneri derivanti da detti contratti.
Basti considerare, a tal riguardo, che, in assenza delle risorse aggiuntive necessarie a finanziarli, la legge n. 289 del 2002 (legge finanziaria 2003), ha procrastinato la stipula di tali contratti per i medici specialisti, per la cui realizzazione si è quindi dovuto attendere l'anno accademico 2006/2007.
Si fa inoltre presente che nel 2008, sempre per dare soluzione alla problematica in questione, questo Ministero aveva effettuato uno studio al fine di quantificare gli oneri derivanti dall'applicazione del citato articolo 8, proponendo di individuare risorse finanziarie aggiuntive con la legge finanziaria per il 2009.
Sulla base di dette stime era stata ipotizzata la necessità di un finanziamento, da parte dello Stato, di circa 800/1000 contratti di formazione per tutte le categorie professionali interessate, con una spesa per il primo anno pari ad euro 20/25 milioni.
Tuttavia, attesa la sfavorevole congiuntura economica, tale proposta non è stata presa in considerazione.
Tutto ciò rappresentato, si osserva che il finanziamento dei contratti di formazione specialistica per le categorie dei professionisti indicati nel citato articolo 8 della legge n. 401 del 2000, ivi compresa quella dei farmacisti, è di interesse strategico per il Servizio Sanitario Nazionale, ove si consideri che la specializzazione è un requisito di accesso sia alla dipendenza sia alle convenzioni di specialistica ambulatoriale.
L'estensione del contratto di formazione specialistica anche ai suddetti professionisti permetterebbe di estendere loro il regime del tempo pieno e l'incompatibilità Pag. 158proprie della formazione medico specialistica, garanzie di una migliore ed adeguata preparazione in sanità pubblica.
Tuttavia, per quanto detto, si ritiene che la problematica possa trovare adeguata soluzione solo attraverso il reperimento di risorse finanziarie aggiuntive rispetto a quelle finora stanziate per i contratti di formazione specialistica medica.
A tale riguardo, non può tralasciarsi di considerare che, per la formazione medico-specialistica, nell'anno accademico 2011/2012, a fronte di un fabbisogno dichiarato di 8.439 medici specialisti, si sono potuti finanziare con le risorse dello Stato solo n. 5.000 contratti, così come, per l'anno accademico 2012/2013, a fronte di un fabbisogno dichiarato di 8.171 medici specialisti, si potranno finanziare solo n. 5.000 contratti.
In considerazione che il decreto ministeriale 1o agosto 2005 ha modificato, innalzandola, la durata delle scuole di specializzazione a partire dall'anno accademico 2008/2009 – prevedendo 5 anni di corso per tutte le scuole e 6 anni di corso per quelle di neurochirurgia e chirurgia generale – tale stato di cose comporterà, conseguentemente, un maggior numero di contratti da finanziare con il medesimo stanziamento annuale.
Pertanto, ad invariato stanziamento di risorse finanziarie, si determinerà un'inevitabile riduzione delle disponibilità destinate ai finanziamenti del primo anno di corso di specializzazione, con la conseguente, consistente, contrazione del numero di nuovi contratti assegnabili per le specializzazioni mediche.